0
发表咨询在线!

发布时间:2021-09-07所属分类:医学论文浏览:1282次
摘 要: 内容提要:通过归纳2013年~2020年金属接骨板产品的国家医疗器械质量监督抽检(以下简称监督抽检)数据,并对监督抽检中发现的主要不合格项目以及产品注册、生产等方面存在的质量风险点进行剖析,最后结合当前行业现状总结了该产品存在的问题、提出了相应的建议

内容提要:通过归纳2013年~2020年金属接骨板产品的国家医疗器械质量监督抽检(以下简称监督抽检)数据,并对监督抽检中发现的主要不合格项目以及产品注册、生产等方面存在的质量风险点进行剖析,最后结合当前行业现状总结了该产品存在的问题、提出了相应的建议。
关键词:金属接骨板监督抽检质量风险点
金属接骨板是一种贴附于骨表面,以提供骨折断端固定的内植入物,主要用于连接固定骨折后的两块或多块骨,通常与金属接骨螺钉或缆线配合使用[1]。金属接骨板按用途可分为:四肢、颅颌面、脊柱接骨板等;按形状可分为:直型、解剖型、角度型、管状接骨板等;按功能分为:保护或中和、支持、加压、重建接骨板等。目前金属锁定接骨板和金属锁定接骨螺钉逐渐成为市场主流,一些可吸收镁基合金、低模量钛合金金属接骨板也正逐步开展临床试验,有望在不远的将来广泛应用于骨科[2,3]。金属接骨板作为Ⅲ类高风险重点监管医疗器械,由国家药品监督管理局(以下简称国家局)负责注册审批,因产品风险程度较高,且临床使用量大,一直是国家监督抽检的重点关注品种。下面就近几年该品种的抽检情况作简要总结。
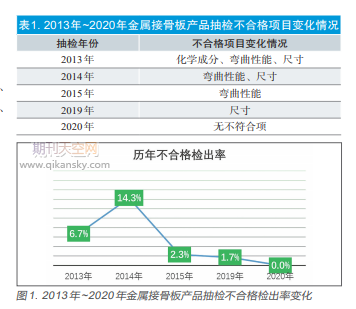
1.整体质量情况
2013年~2020年国家局共组织对金属接骨板产品开展监督抽检5次,总体企业覆盖率67%。依据强制性行业标准YY0017和产品技术要求进行检验,不合格检出率分别为2013年6.7%,2014年14.3%(该年度抽样批数少,不合格检出率不具代表性),2015年2.3%,2019年1.7%,2020年0.0%。不合格项目主要集中在化学成分、弯曲强度和等效弯曲刚度、尺寸等项目。从历次抽检数据可以看出,产品不合格检出率和不合格项目总体呈现逐年改善趋势,详见表1、图1。
2.主要不合格项目和探索性研究分析
监督抽检项目通常包括法定检验项目和探索性研究项目,法定检验项目主要针对强制性标准中规定的性能指标,探索性研究项目主要针对一些刚纳入标准或尚未纳入标准,但对产品安全性和有效性有重要影响的项目。下面针对法定检验发现的主要不合格项目和探索性研究中发现的一些问题作简要分析。
2.1法定检验不合格项目分析
2.1.1化学成分项
材料的化学成分是决定其产品性能的重要基础,一旦原材料不符合标准要求,其力学性能和植入人体后的生物相容性都将无法保证,因此,行业标准中对接骨板产品的材料选取有严格规定。2013年监督抽检中,有1批次产品的化学成分不合格。该批产品技术要求中规定接骨板采用GB4234-2003中00Cr18Ni15Mo3N牌号的不锈钢材料制造,实测结果为00Cr18Ni14Mo3牌号不锈钢材料。后者虽然也属于外科植入物常用的不锈钢材料,但不同牌号材料的混用,反映了该企业对原材料管理、品控、合规等方面存在一定问题。
2.1.2弯曲项
弯曲是金属接骨板植入人体后最常见也是最重要的受力形式,临床上绝大多数接骨板的断裂均与弯曲载荷有关。弯曲强度和等效弯曲刚度是评价接骨板弯曲性能的重要指标。接骨板产品不仅应保证足够的弯曲强度以满足使用要求,其等效弯曲刚度也应在一定的范围内,使其弹性模量尽可能接近人体骨骼的模量值。材料问题、设计不合理、加工不当等原因均会导致接骨板的弯曲强度不够和刚度过大或过小,严重者可造成植入物在手术过程中及后期在体内断裂。2013、2014、2015年连续3年抽检中,均发现有弯曲强度和等效弯曲刚度检测结果不合格。
以2015年抽验中弯曲项的结果为例,某接骨板注册产品标准中规定弯曲强度应≥0.08N·m,实际检测结果为4.09~4.39N·m,等效弯曲刚度应为0.005~0.6N·m2,实际检测结果为1.051~1.118N·m2。等效弯曲刚度约为企业规定值上限的两倍,分析可能的原因为该项指标的制定未经充分验证。
2.1.3尺寸项
金属接骨板通常需要与接骨螺钉配合使用,接骨板孔径不合格可能导致在临床手术中,与其配合使用的螺钉无法拧入和取出,从而影响医生的手术过程以及给产品术后取出带来困难,因此行业标准中对接骨板的孔径允许偏差有严格要求。以2014年监督抽检中尺寸项为例,共抽取21批次接骨板产品,3批次产品尺寸不合格。其中一批次金属接骨板孔径标准值为4.2mm,公差为0~0.2mm,实测值为4.44~4.46mm,实测值均超过其标准值;另两批次接骨板孔径标准值为3.9mm、4.4mm,而实际产品的检测结果为“4.24mm、4.25mm、4.27mm”和“4.24mm、4.26mm、4.27mm”。分析导致不合格的可能原因是机加工导致偏差或未依据产品技术要求进行生产。另外也说明企业出厂检验把关不严。
2.2探索性研究结果分析
充分利用监督抽检的大样本平台开展探索性研究,这对标准的制修订、产品风险管控以及质量监管等具有重要意义。以下是对金属接骨板产品2项探索性研究情况的总结。2.2.1钛及钛合金材料中H元素含量对新版标准GB/T13810-2017的符合性
H元素在α相中溶解度很小,钛合金中溶解过多的氢会产生氢化物,使合金变脆,H元素具有很高的吸附能力和扩散迁移能力,对相变过程和组织结构的形成有着强烈的影响。GB/T13810-2017《外科植入物用钛及钛合金加工材》于2018年5月1日实施,其中H含量由不大于0.010%修改为不大于0.008%。本次探索目的是考察金属接骨板产品中H元素对新版国家标准的符合性。
通过对抽到的52批钛及钛合金样品中H元素含量试验结果数据分析,除一批产品H元素含量为0.0091%,略高于标准中0.008%的要求,但在允许偏差范围内,其余51批次接骨板产品的H元素含量均不高于0.0048%。
结论:从数据可以看出,当前金属接骨板用钛及钛合金材料基本都能够满足新版GB/T13810-2017中关于H元素含量要求。对于H元素含量较高的这批产品,企业应关注原材料采购、生产和质检等环节,对于接骨板成品的杂质元素应有更加严格的把控。
2.2.2接骨板四点弯曲疲劳试验
接骨板的弯曲疲劳性能直接关系到植入物在人体内的使用安全。YY0017-2016于2018年6月1日实施,其中明确规定了应对金属接骨板产品进行疲劳性能的检测。本次抽检选取静态屈服载荷的40%作为疲劳载荷,目的是探索金属接骨板成品的耐疲劳性能。
共对21批次金属接骨板进行疲劳研究,仅有一批次钛合金产品未通过疲劳试验,在91479次时发生断裂,该产品正是前面所述H元素偏高的金属接骨板。结合H元素会使钛合金产品变脆这一特征,可以初步判断H元素的升高可能会降低接骨板产品的疲劳性能。
相关论文文献您还可以参考:医疗器械系统工程师论文参考文献推荐
结论:探索实验结果反映出目前多数金属接骨板的疲劳性能较好,但不同企业产品的疲劳性能差别较大。作为金属接骨板的一项重要安全性指标,处于较低水平的相关企业应从材料选择、产品设计、表面处理工艺等影响疲劳性能的关键因素方面进行持续改进,不断提高金属接骨板产品的耐疲劳性能。
3.监督抽检发现的相关质量风险点
3.1产品技术要求引用强标项目不全
抽检中发现,个别产品技术要求引用强标项目不全。如产品技术要求中缺少金属接骨板的弯曲强度和等效弯曲刚度项目的情况,该指标在行标YY0017-2008中已规定,标准于2010年6月1日实施。考虑到目前市场上接骨板产品的注册周期为4年或5年,理论上,抽检涉及的产品技术要求均应对弯曲强度和等效弯曲刚度进行规定,但抽检中仍发现个别产品技术要求中未引用该项目。
3.2产品技术要求中规定的性能指标不明确
抽检中发现,部分产品技术要求中规定的性能指标不明确,如技术要求中接骨板孔径d1无具体对应值,且产品上有多种孔型,也未在技术要求中区别标注;另外产品表面处理工艺有抛光、喷砂等多种工艺,但技术要求和产品标签中均未进行详细区分标注等。
3.3同批次产品性能差异较大
抽检中发现,部分同批次产品检测结果相差较大。如某企业生产的金属接骨板产品,其孔径尺寸要求为4.0mm,公差为0~0.2mm,实际检验结果为4.07~4.17mm,虽然检测结果均符合规定,但尺寸数据一致性较差,从侧面反映出其机加工工艺稳定性不佳,质量管理体系有待完善。
3.4出厂检验把关不严
抽检中抽取了企业出厂自检报告,通过对自检报告的核查发现如下问题:①部分自检报告无任何结果数据,仅为符合要求;②部分报告中要求的标称值与技术要求不相符;③甚至有自检报告中检验结果本身不符合技术要求。从以上情况可以看出,少数企业对出厂检验不够重视,未严把产品质量的最后一关。
4.针对抽检发现的问题的意见建议
针对近几次金属接骨板抽检中发现的主要问题,建议企业关注以下几个方面:①产品技术要求对强制性行业标准引用的完整性和准确性,避免因注册申报环节的疏忽导致的技术指标缺少,不明确等情况;②产品技术指标的制定应经过充分验证和确认;③完善质量管理体系,确保工艺的稳定性和产品性能的一致性;④提高检验能力,严格过程检验和出厂检验,保证出厂产品符合技术规范。
随着新条例的发布实施,将强化对医疗器械的上市后抽查检验,并加大了处罚力度,提高了违法成本,因此,相关企业应该加强医疗器械全生命周期的管理,保证产品“安全、有效、质量可控”。——论文作者:赵丙辉董双鹏马金竹*李沅
澹版槑:鈶犳枃鐚潵鑷煡缃戙€佺淮鏅€佷竾鏂圭瓑妫€绱㈡暟鎹簱锛岃鏄庢湰鏂囩尞宸茬粡鍙戣〃瑙佸垔锛屾伃鍠滀綔鑰�.鈶″鏋滄偍鏄綔鑰呬笖涓嶆兂鏈钩鍙板睍绀烘枃鐚俊鎭�,鍙仈绯�瀛︽湳椤鹃棶浜堜互鍒犻櫎.
SCISSCIAHCI