0
留言稍后联系!

发布时间:2020-02-14所属分类:农业论文浏览:1282次
摘 要: 摘要:本文分别采用乳酸菌与酵母菌发酵提取仙人掌多糖,并探究仙人掌多糖的抗炎功效。在三个单因素液料比、时间、pH方面探究仙人掌多糖的提取工艺,得到三因素最适组合,乳酸菌发酵最适提取工艺为发酵时间7h、液料比25∶1(mL/g)、pH为5,此工艺下多糖得率为0.

摘要:本文分别采用乳酸菌与酵母菌发酵提取仙人掌多糖,并探究仙人掌多糖的抗炎功效。在三个单因素液料比、时间、pH方面探究仙人掌多糖的提取工艺,得到三因素最适组合,乳酸菌发酵最适提取工艺为发酵时间7h、液料比25∶1(mL/g)、pH为5,此工艺下多糖得率为0.26%。黄酒酵母发酵最适提取工艺为发酵时间48h、液料比25∶1(mL/g)、pH为3,此工艺下多糖得率为0.53%。应用实时荧光定量PCR法检测仙人掌多糖对IL-6、IL-8炎症细胞因子相关基因表达的影响,得知仙人掌多糖通过抑制IL-8的表达,促进IL-6的表达来抑制炎症的发生和发展。
关键词:仙人掌多糖,微生物提取技术,乳酸菌,酵母菌,抗炎
仙人掌(OpuntiadilleniiHaw)属仙人掌科仙人掌属植物,是热带及亚热带植物,多生长于美洲及墨西哥干旱荒漠或者是半荒漠地区,其中以墨西哥分布最多。我国主要分布在广西、江西、广东、福建、海南等地。仙人掌用途广泛,如食用、做观赏植物、药用等。赵学敏所著的《本草纲目拾遗》中记载,仙人掌可作为药用植物,其具有清热解毒、安神利尿、行气活血、消肿止痛、健脾止泻的功效,可内服,亦可外用治疗疾病。
仙人掌内丰富的仙人掌多糖(Opuntiadilleniipolysaccharide,ODP)是其有诸多功效的主要原因之一。ODP主要从仙人掌的果实和茎里提取而来,极性大分子化合物葡萄糖、鼠李糖和阿拉伯糖是其主要组成物质。目前,ODP的抗氧化、抗炎抑菌、免疫、降血糖血脂、抗肿瘤、护肝[1-10]等多种功效都已被证实。除上述的药理功能,ODP还可防脱发[11],治疗神经退行性疾病药物[12],促进小鼠腹腔巨噬细胞的吞噬功能[13]。如今,仙人掌应用愈加广泛,如:市面上已有仙人掌制的果蔬汁、保健品和面粉制品出售。
传统的提取多糖的方法如包含水提、碱提、酸提、苯酚提取、微波辅助提取、超声辅助提取和酶提等方法[14],存在多糖提取率低,纯度不高,原料浪费严重,且影响对多糖进行结构分析和功效鉴定等问题[15]。本实验采用微生物法提取多糖,是利用微生物在生长过程中,会利用其他营养物质进行生长,但并不利用多糖对植物多糖进行去杂纯化,反应条件温和且能耗少。此外,因新鲜仙人掌肥厚的肉质茎含有丰富的蛋白质、矿物质、纤维素和维生素C等,同时含有丰富的SOD、黄酮类及多糖等活性功能成分[16],所以本实验采用新鲜的仙人掌叶片来进行试验。本文研究将从以下两个方面进行:一是用乳酸菌、酵母菌发酵新鲜仙人掌来探究ODP提取工艺;二是用发酵得到的多糖液做抗炎实验,探究ODP的抗炎活性。
1材料与方法
1.1材料与仪器
新鲜仙人掌生长期为3~8个月,云南白药集团公司;硫酸、苯酚、葡萄糖(均为国产分析纯)北京化工厂;乳酸菌北京川秀科技有限公司;酵母菌中国科学院微生物所;Hacat细胞中国检验检疫科学研究院中德化妆品研究所细胞毒理实验室;水、过滤超纯水实验室制备。
BS2202S型电子天平、A2492型电子天平北京赛多利斯仪器系统有限公司;HR2195搅拌机匀浆机飞利浦有限公司;YZB-苏(锡)1132-2004低速大容量离心机无锡市瑞江分析仪器有限公司;T6新世纪紫外可见分光光度计北京普析通用仪器有限公司;DSHZ-300恒温水浴振荡器江苏省太仓市实验设备厂;电热恒温水浴锅北京长安科学仪器厂;WJ-80A-ⅡCO2培养箱上海圣科;细胞培养瓶、板,冻存管美国Corning/Costar;ABI7300型荧光定量PCR仪美国应用生物系统公司;SW-CJ-1D超净工作台上海启前电子科技有限公司;Enduro水平电泳仪美国Labnet公司;Sigma1-14微型离心机德国Sigma;Sigma3-30K高速台式冷冻离心机德国Sigma;GeneAmpPCRSystem9700PCR仪美国ABI应用生物系统公司。
1.2实验方法
1.2.1ODP提取工艺新鲜仙人掌茎洗净、去刺、去皮后切碎,用匀浆机匀浆2min,再进行高压灭菌(120℃,30min),在超净台将加入4mL菌液加入100mL仙人掌匀浆液中后用封口膜封口,于空气摇床(180r/min)培养,而后离心(20000r/min,10min)取上清,用旋蒸仪将上清液浓缩至原体积的1/3,再以3倍体积95%乙醇醇沉12h,再一次离心(20000r/min,10min),取沉淀热水(60℃)溶解得粗多糖液。
1.2.2ODP含量测定标准曲线绘制:参照苯酚硫酸法[17],结果显示在0~120μg/mL浓度范围内,葡萄糖与A490呈良好的线性关系,以吸光度对多糖浓度C进行线性回归,得到回归方程:y=0.0151x+0.0042(R2=0.9996),y表示吸光度值A490,x表示仙人掌多糖的浓度,μg/mL。
ODP样品含量测定:取两只带塞试管,分别吸取1mL待测液和1mL去离子水,再分别依次添加0.5mL5%苯酚,摇匀后加入2.5mL浓硫酸,盖上试管盖,再充分摇匀,静置5min后,置于水浴锅中沸水浴1h,测定吸光值A490。并根据回归方程计算ODP浓度。
ODP得率(%)=所得的ODP浓度×仙人掌多糖液体积/仙人掌的质量×100
1.2.3乳酸菌发酵法的单因素实验
1.2.3.1时间对多糖得率的影响将提取的液料比固定为20∶1(mL/g),温度固定为35℃,pH固定为7,选取5个时间梯度5、6、7、8、9h,作为探究乳酸菌发酵提取时间的单因素条件,取一定量的多糖溶液,测定该因素下提取得到的多糖含量,从而计算得到多糖得率。
1.2.3.2液料比对多糖得率的影响将提取时间固定为7h,pH固定为7,温度固定为35℃,选取5个液料比梯度10∶1、15∶1、20∶1、25∶1、30∶1(mL/g),作为探究乳酸菌发酵提取液料比的单因素条件,取一定量的多糖溶液,测定该因素下提取得到的多糖含量,从而计算得到多糖得率。
1.2.3.3pH对多糖得率的影响将提取的液料比固定为20∶1(mL/g),温度固定为35℃,时间固定为7h,选取5个pH梯度为3、4、5、6、7,作为探究乳酸菌发酵提取pH的单因素条件,取一定量的多糖溶液,测定该因素下提取得到的多糖含量,从而计算得到多糖得率。
按以上实验所得的最佳单因素条件进行实验,计算最大的仙人掌多糖得率。
1.2.4酵母菌发酵法的单因素实验
1.2.4.1时间对多糖得率的影响将提取的液料比固定为20∶1(mL/g),发酵温度固定为28℃,pH固定为5.5,选取5个时间梯度24、36、48、60、72h作为探究黄酒酵母发酵提取时间的单因素条件,取一定量的多糖溶液,测定该因素下提取得到的多糖含量,从而计算得到多糖得率。
1.2.4.2液料比对多糖得率的影响将提取时间固定为48h,pH固定为5.5,温度固定为28℃,选取5个液料比梯度10∶1、15∶1、20∶1、25∶1、30∶1(mL/g),作为探究黄酒酵母发酵提取液料比的单因素条件,取一定量的多糖溶液,测定该因素下提取得到的多糖含量,从而计算得到多糖得率。
1.2.4.3pH对多糖得率的影响将提取的液料比固定为25∶1(mL/g),温度固定为28℃,时间固定为48h,选取5个pH梯度3、4、5、6、7作为探究黄酒酵母发酵提取pH的单因素条件,取一定量的多糖溶液,测定该因素下提取得到的多糖含量,从而计算得到多糖得率。
1.2.5细胞培养冻存人表皮永生化细胞(Hacat细胞)从-80℃的冰箱中取出后,迅速37℃水浴,轻微震动1~2min使其彻底融化。1000r/min离心10min,弃上清。加1mL细胞培养液(Dulbecco’sModifiedEagle’smedium,DMEM),转移到10cm2培养瓶中,置于37℃5%CO2环境中培养。细胞生长到90%融合时,动作轻柔地用2mL磷酸盐缓冲液(pH7.4)洗两次。加200μL0.25%胰酶后,放入CO2培养箱中消化5min,在观察确认细胞已从培养瓶壁上脱落后,加2mL的完全培养液终止消化,800r/min离心l0min,去上清液,加入4mL培养液,计数后,以5×105密度接种于10cm2培养瓶。
1.2.6MTT法测定Hacat细胞毒性实验选取对数生长期状态良好的Hacat细胞。用0.25%胰蛋白酶将Hacat细胞消化,1500r/min离心1min后重悬于含有10%胎牛血清的DMEM培养基中,计数;用96孔培养板接种细胞,并设置空白对照,边缘孔用无菌磷酸盐缓冲液(PBS)填充,在5%CO2,37℃环境中培养12h;按照各自终浓度分别加入ODP,细胞对照组是未做处理的组,每组设3个复孔,培养44h后,加入5g/L的MTT溶液,继续在37℃,5%CO2环境中培养4h后终止培养;吸除孔内液体,用PBS洗涤1次,加入DMSO溶解结晶;M3读板仪测定各孔吸光度值A570。分别用0.5、1、2、2.5、5mg/mLODP处理Hacat细胞。
Hacat细胞存活率(%)=(测定孔吸光度值-空白对照组吸光度值)/(细胞对照组吸光度值-空白对照组吸光度值)×100
1.2.7ODP处理时间对炎症细胞因子IL-6、IL-8基因表达的影响将消化后的细胞(消化方法参照1.2.5),以2×106/孔的密度接种6孔板内,以0.5mg/mL的ODP处理细胞不同时间(0、0.5、1、1.5、2h)。提取细胞总RNA,荧光定量分析处理对炎症细胞因子在转录水平表达的影响,内参基因定为β-actin。
1.2.8炎症细胞因子IL-6、IL-8基因在转录水平表达量的测定
1.2.8.1细胞总RNA提取与检测总RNA提取及琼脂糖凝胶电泳检测RNA,参照文献[18-19]。
1.2.8.2cDNA第一链合成使用TINAGENFastQuantRTKit(WithgDNase)FastQuantcDNA第一链合成试剂盒(去基因组)进行cDNA第一条链合成反应。将得到的cDNA中加1000μLddH2O,稀释混匀,-20℃保存。
1.2.8.3引物及探针的设计和合成根据NCBI发布的IL-6、IL-8等基因的序列,用PrimerExpress软件设计特异性引物,同时设计管家基因β-actin的特异性引物。基因引物序列见表1。
1.2.8.4实时荧光定量PCR以cDNA为模板,反应体系为20μL,其中PrimeScriptRTEnzymeMIX10.4μL,ddH2O7.6μL,正向、反向引物各0.5μL,cDNA模板1μL,使用ABI7300荧光定量PCR仪扩增实验样本,扩增条件为95℃2min预变性,然后按95℃15s,57℃20s,72℃30s,做42个循环,在72℃收集荧光信号。
1.3数据处理
实验中每个处理重复三次,用SPSS25.0软件进行数据的显著性分析,应用Origin9.0软件作图。
2结果与分析
2.1乳酸菌发酵提取多糖单因素实验
2.1.1时间对得率的影响按照方法
2.1.2液料比对得率的影响按照方法1.2.3.2探究不同液料比对ODP提取的影响,结果见图2,随着液料比的增加,ODP得率显著性增加(p<0.05),当液料比为20∶1mL/g增加为25∶1mL/g时,得率不显著增加达到最大值0.23%(p>0.05),随后得率显著性下降(p<0.05)。这是因为在一定范围内,增加提取液体积可以增加溶剂与提取物质的接触面积,使多糖得以较多溶出,但继续增加提取液体积会使多糖达到饱和[20]。因此,乳酸菌发酵提取的最佳提取液料比为25∶1mL/g。
2.1.3pH对得率的影响按照方法
1.2.3.3探究不同pH对ODP提取的影响,结果见图3,随着pH升高,ODP得率显著增加(p<0.05),在pH=5时得率达到了最大值0.28%,pH在5~6时得率不显著降低(p>0.05),超过6之后,得率显著降低(p<0.05)。这是因为乳酸菌适宜在弱酸情况下生长,随着pH的降低,菌体生长受到抑制[21]。因此,选取5作为乳酸菌发酵提取的最佳pH。以温度为35℃,时间为7h,pH为5,液料比为25∶1mL/g为试验条件,提取ODP,所得的ODP得率为0.26%。经过工艺优化的热水浸提法得到的得率最高为0.12%[22],乳酸菌发酵的ODP得率比热水浸提法的得率高出0.14%。
2.2酵母提取多糖的单因素实验
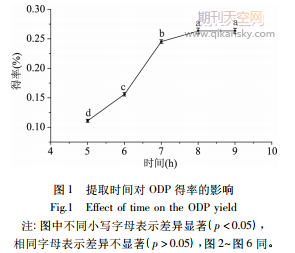
2.2.1时间对得率的影响按照方法
2.2.2液料比对得率的影响按照方法
1.2.4.2探究不同液料比对ODP提取的影响,结果见图5,随着液料比的增加,ODP得率发生显著性变化,当液料比达到20∶1mL/g,ODP出现降低,当液料比达到25∶1mL/g,得率升高到最大为0.48%,随后得率显著下降(p<0.05)。这是因为在一定范围内,随着液料比的增大,提取液体积变大,提取的损耗增加,在液料比20∶1mL/g时损耗增大量大于提取率的增大量,当提取液体积继续增大时,损耗比提取得率的增加量小,但当达到某一提取液体积时,多糖溶出会达到饱和从而使ODP得率下降。因此,取25∶1mL/g为黄酒酵母发酵提取最佳液料比。
2.2.3pH对得率的影响
按照方法1.2.4.3探究不同pH对ODP提取的影响,结果见图6,在pH=3时ODP得率最高0.53%,随着pH的增加得率显著降低(p<0.05)。黄酒酵母适应偏酸性环境,但不适应强酸。因此,黄酒酵母发酵提取最佳pH为3。
经过工艺优化的热水浸提法得到的得率最高为0.12%[22],经本实验所得的黄酒酵母发酵的工艺条件为温度28℃,时间48h,液料比25∶1mL/g,pH为3,得率能达到0.53%,比热水浸提法得率到了4倍。
2.3MTT法测定Hacat细胞毒性如图7所示,以未加任何ODP的细胞作空白对照,当ODP浓度高达2mg/mL时,细胞增殖活力依然超过90%,说明ODP对细胞几乎无毒性。且当ODP浓度减小,细胞增殖活力反而增加,ODP浓度为0.5mg/mL时,细胞存活率高达109.07%,说明低浓度ODP对HacaT有增殖作用。
2.4ODP处理时间对炎症细胞因子IL-6、IL-8基因表达的影响
考察时间效应,用ODP处理Hacat细胞,2h内炎症因子类基因(IL-6、IL-8)表达量产生了不同的变化。
促炎症因子IL-6是一种在炎症和免疫反应中具有多种功能细胞因子,可以促进炎症反应中花生四烯酸的释放,刺激T细胞活化和增殖,提高B细胞中免疫球蛋白的生成,并且诱导急性期反应蛋白的产生[23]。ODP添加时间对促炎症因子IL-6表达量的影响如图8所示,可看出15min内基因表达量出现降低,15~30min时间内IL-6表达量平缓升高,而在30~90min时间内,表达量发生了显著的提高(p<0.01),此后又缓慢下降,在2h的表达量与60min时的表达量差不多,但是显著高于初始值(p>0.05)。整体来看,30min后的促进作用是ODP对IL-6基因表达量的主要影响。ODP对IL-6基因表达量的影响作用,可验证ODP可能是通过促进IL-6基因的表达从而影响花生四烯酸的代谢而起到抗炎作用的。
IL-8在许多炎症反应中具有聚集和激活淋巴细胞、白细胞和血管内皮细胞的功能,可因局部产生的IL-8直接作用于表皮细胞,促进慢性炎症的发展[24]。ODP添加时间对的其表达量的影响如图9所示,IL-8基因的表达量在15min内迅速下降,显著低于初始值(p<0.01),并在之后的15min内继续缓慢下降,在30~90min这段时间内在保持显著小于初始值的范围内缓慢上升(p<0.05),而之后到2h之间,其又缓慢下降。整体来看,在0~15min内ODP迅速抑制IL-8的表达,并在2h的时间内ODP始终保持抑制IL-8的表达,这是ODP对IL-8基因作用的主要体现。大量的中性粒细胞因IL-8表达的增高而向炎症区域聚集,从而释放炎症介质加重炎症反应。IL-8的表达因受到ODP作用而受到抑制,间接地炎症的发生和发展就受到抑制。
推荐阅读:食品加工工艺论文文献
食品从业人员在晋升职称时,也会要求发表论文,最近也有作者咨询食品加工工艺方向的论文文献,为此小编检索了期刊天空网站的范文库,在这里给大家分享了食品加工工艺论文范文,需要投稿的作者可以作为参考,或者您也可以将您具体的工作专业与期刊天空的老师沟通,他们会结合您的实际情况,给分享更合适的论文文献。
3结论
在本课题的研究中,采用乳酸菌与黄酒酵母对用微生物法提取多糖进行了初步探索。结果显示,同样直接使用新鲜的仙人掌汁进行提取,采用乳酸菌发酵最适提取工艺:发酵时间7h、液料比25∶1(mL/g)、pH为5,此工艺下多糖得率为0.26%。黄酒酵母发酵最适提取工艺:发酵时间48h、液料比25∶1(mL/g)、pH为3,此工艺下多糖得率为0.53%,黄酒酵母发酵所得ODP得率远远高于乳酸菌,因此选取黄酒酵母作为发酵菌种提取ODP会更有优势。本课题也探究了ODP抗炎能力,结果显示ODP通过抑制IL-8的表达,促进IL-6的表达来抑制炎症的发生和发展,为研究仙人掌的抗炎效果提供理论依据。
婢圭増妲�:閳剁姵鏋冮悮顔芥降閼奉亞鐓$純鎴欌偓浣烘樊閺咁喓鈧椒绔鹃弬鍦搼濡偓缁便垺鏆熼幑顔肩氨閿涘矁顕╅弰搴㈡拱閺傚洨灏炲鑼病閸欐垼銆冪憴浣稿灁閿涘本浼冮崰婊€缍旈懓锟�.閳垛€愁洤閺嬫粍鍋嶉弰顖欑稊閼板懍绗栨稉宥嗗厒閺堫剙閽╅崣鏉跨潔缁€鐑樻瀮閻氼喕淇婇幁锟�,閸欘垵浠堢化锟�鐎涳附婀虫い楣冩6娴滃牅浜掗崚鐘绘珟.
SCISSCIAHCI