0
发表咨询在线!

发布时间:2022-01-26所属分类:农业论文浏览:1760次
摘 要: 摘 要:采用组织分离法分离江苏省宿迁市多肉植物青星美人的黑腐病病原菌,通过形态学观察、rDNAITS 序列分析和致病性测定,确定病原菌的分类学地位,并测定温度、pH、光照、碳源和氮源对病原菌菌丝生长和产孢量的影响。结果表明:引起宿迁地区青星美人黑腐病的致病病原

摘 要:采用组织分离法分离江苏省宿迁市多肉植物青星美人的黑腐病病原菌,通过形态学观察、rDNA–ITS 序列分析和致病性测定,确定病原菌的分类学地位,并测定温度、pH、光照、碳源和氮源对病原菌菌丝生长和产孢量的影响。结果表明:引起宿迁地区青星美人黑腐病的致病病原菌为暹罗炭疽菌(Colletotrichum siamense),该病原菌最适菌丝生长和产孢量的温度为 30 ℃,5 ℃时菌丝生长极其缓慢并停止产孢,40 ℃时菌丝死亡并停止产孢;菌丝生长的最适 pH 5.0,产孢的最适 pH 7.0;病原菌能利用多种碳源和氮源,麦芽糖为菌丝生长和产孢的最佳碳源,蛋白胨为产孢最佳氮源,酵母浸膏为菌丝生长最佳氮源,硫酸铵对菌丝生长和产孢有抑制作用;光暗交替适合菌丝生长,连续黑暗适合产孢。
关 键 词:青星美人;黑腐病;暹罗炭疽菌;生物学特性
多肉植物青星美人(Pachyphytum ‘Dr Cornelius’) 是景天科(Crassulaceae)厚叶草属(Pachyphytum)和拟石莲花属(Echeveria)的属间杂交种,原产于墨西哥[1],是江苏宿迁种植的主要多肉植物品种。近年来,青星美人黑腐病发生较为严重,已成为宿迁多肉植物产区的主要病害,严重影响青星美人的品质和种植规模。青星美人植株的根、茎、叶、花等部位均可能染病,叶片受害后先褪色、变软、水化、枯萎,然后整张叶片迅速发黑腐烂,最后造成植物整株死亡;因此,明确青星美人黑腐病原菌种类及其生物学特性,对青星美人黑腐病的防控具有重要意义。目前,有关多肉植物黑腐病病原结论不一:王贝贝[2]曾从山东青州地区景天科多肉植物雪莲上分离出黑腐病的病原菌为 Fusarium inflexum ;刘浩等[3]研究认为,多肉植物彩虹黑腐病病原菌为 Fusarium oxysporum;姚锦爱等[4]认为福建漳州景天科多肉植物翡翠景天黑腐病病原菌为山扁豆生棒孢(Corynespora cassiicola)。可见,不同多肉植物的黑腐病是由不同病原菌侵染造成的。笔者从江苏省宿迁市耿车镇多肉植物种植基地采集青星美人的黑腐病典型病株,分离、纯化病原菌,采用形态学观察、rDNA–ITS 基因序列分析和致病性测定相结合的方法进行病原鉴定,并对病原菌进行生物学特性研究,以期为多肉植物青星美人黑腐病的防控提供科学依据。
1 材料与方法
1.1 材料
于 2019 年 8 月采集宿迁市耿车镇多肉植物种植基地的青星美人黑腐病典型症状的病害标本,保存于宿迁学院园林专业植物病理实验室。
1.2 方法
1.2.1 青星美人黑腐病病原菌的分离及鉴定
参照文献[5]的方法,采用室内组织分离法获得青星美人黑腐病病原菌株,并于 26 ℃ 保存在 PDA 斜面培养基,备用。
将病原菌接种到 PDA 平板上,培养 5 d,观察菌落形态、颜色及菌丝生长状况;培养 10 d 后,在光学显微镜下观察分生孢子和菌丝附着胞的形态特征。应用真菌基因组 DNA 提取试剂盒(南京擎科生物科技有限公司产品,型号 D2300–50T)提取病原菌株的基因组 DNA。用 rDNA–ITS 基因通用引物 ITS1/ITS4(ITS1,5'–TCCGTAGGTGAACCTGCGG– 3';ITS4,5'–TCCTCCGCTTATTGATATGC–3')PCR 扩增。反应条件:95 ℃预变性 5 min;95 ℃变性 15 s,50 ℃退火 20 s,72 ℃延伸 40 s,40 个循环,最后 72 ℃延伸 5 min。按 Axygen DNA 凝胶回收试剂盒(目录号 AP–GX–50)说明书操作回收 PCR 扩增产物,送至南京金斯瑞生物科技有限公司测序。对所获得的基因序列,在 NCBI 网站进行 BLAST 同源性比对。通过比对选取相似度高的20 条基因序列,利用 MEGA 6.0 软件进行系统发育树的构建。
1.2.2 病原菌致病性的测定
挑选培育期约 1 年、株高 12~15 cm 的健康盆栽青星美人植株用于致病性测定。选取青星美人植株中部健叶,用无菌水反复冲洗,用 75%的乙醇消毒 3 s,用 0.1%的 HgCl2溶液消毒 3 min,再用无菌水冲洗 3~4 次,最后用灭菌的吸水纸吸干表面的水分。用无菌针头轻轻刺伤消毒处理过的青星美人叶片上表皮,在伤口处敷上 3 mm×3 mm 待测菌株的菌丝块,以无菌 PDA 琼脂块接种作对照。将接种的青星美人叶片置于 26 ℃的植物气候箱内,12 h 光照加 12 h 黑暗处理,观察发病情况。将发生黑腐病典型症状的青星美人叶片病组织再次分离,并进行形态学观察和分子鉴定。
1.2.3 病原菌生物学特性的测定
选用 PDA 平板,pH 为 7.0,设置 5、10、15、 20、25、30、35、40 ℃ 共 8 个温度梯度,3 次重复。用灭菌打孔器取直径为 5 mm 的菌盘,移至平板正中央,置于全黑暗条件下培养 5 d,每个菌落测定 3 个方向直径,取平均值,计算菌丝生长速率,培养 10 d 后每皿加入 10 mL 无菌水洗脱孢子,用血球计数板法[6]测定产孢量。
用 1 mol/L 的 HCl 和 1 mol/L 的 NaOH 将 PDA 培养基分别调节成 pH 为 3.0、4.0、5.0、6.0、7.0、 8.0、9.0、10.0、11.0,共 9 个处理,3 次重复,在 26 ℃下测定菌丝生长速率和产孢量。
选用 PDA 培养基,pH 为 7.0,设置 24 h 连续黑暗、24 h 连续光照和光暗交替(12 h 光照加 12 h黑暗)3 个处理,3 次重复,在 26 ℃下测定菌丝生长速率和产孢量。
参照胡永亮等[7]的方法,采用真菌生理培养基 (MgSO4·7H2O 0. 5 g,KH2PO4 0. 5 g,琼脂 20 g,碳源 5 g,氮源 1 g,蒸馏水 1000 mL),分别以木糖醇、蔗糖、可溶性淀粉、D–果糖、葡萄糖和麦芽糖为碳源,以不加碳源培养基为对照;分别以尿素、酵母浸膏、硫酸铵、蛋白胨、甘氨酸和脯氨酸为氮源,以不加氮源培养基为对照,在 26 ℃下测定菌丝生长速率和产孢量。
2 结果与分析
2.1 青星美人黑腐病病原菌的鉴定结果
青星美人黑腐病病原菌为害植株根部、茎秆和叶片,茎秆和叶片发病较重。叶片多从基部开始发病,病叶退绿、软化并逐渐化水,发病部位开始出现黑斑,病斑逐渐扩大至全叶,发病后期叶片上出现黑褐色小点(病征),腐烂脱落(图 1)。
分离纯化后菌株的培养性状如图 2 所示。菌落正面(图 2–1)产生浅灰白色气生菌丝,菌丝发达且较为致密;菌落背面(图 2–2)为浅灰白色,菌落正中央略带淡黄色;菌丝附着胞(图 2–3)为棕褐色,近圆形或椭圆型,边缘完整、平滑或不规则;分生孢子(图 2–4)近圆柱状,一端钝圆,另一端钝圆或稍尖细。根据病原菌的形态学特征,结合杨友联等[8]、李杨[9]、王杰等[10]、徐丹丹等[11]和 SOARES 等[12]的描述,初步判定该菌株可能属于胶孢炭疽复合种 (Colletotrichum gloeosporioides species complex)或暹罗炭疽复合种(Colletotrichum siamense species complex)。 1 菌落正面;2 菌落背面;3 菌丝附着胞;4 分生孢子。图 2 青星美人黑腐病病原菌的形态特征 Fig.2 The morphological characteristic of black rot pathogen in Pachyphytum ‘Dr Cornelius’ 以分离得到的病原菌株 DNA 为模板,基于通用引物 IST1 和 IST4 进行 PCR 扩增,得到的 ITS 基因泳带大小在 500 bp 以上。测序结果表明,该 PCR 产物扩增的目的基因片段序列全长为 543 bp。在 NCBI/BLAST 上对该菌株(J257–01)的基因序列进行同源性比对,发现其与暹罗炭疽菌 C. siamense 模式菌株序列(Gene accession No. KM268865.1, KC702973.1, MH939973.1,KX786431.1,MH939974.1, MH939977.1,MT229430.1)相似度达 100%;与 fungal sp. 模式菌株序列 (Gene accession No. MG490812.1,MG490789.1, MG490768.1,MG490759.1) 相似度为 99%;与 C. tropicale 模式菌株序列(Gene accession No. MK330040.1)相似度为 99%。从 NCBI/ GenBank 中选取近源菌株 rDNA–ITS 基因序列,以 Colletotrichum parsonsiae 菌株(Gene accession No. MH865006.1)作为外群序列构建系统发育树,结果(图 3)表明,选取的近源 DNA 序列分属于 4 个不同的进化分支,C. siamense 与 C. tropicale 亲缘关系比较近,在进化上属于同一分支,引起青星美人黑腐病的菌株 PCR 扩增产物与 C. siamense 属于同一分支,可以确定引起青星美人黑腐病的菌株为暹罗炭疽菌(Colletotrichum siamense)。
2.2 青星美人黑腐病病原菌的致病性
将纯化后菌株的菌丝接种于健康的青星美人叶片,定期观测发病情况:图 4–1 为对照,可见叶片仍保持绿色,叶片不发病,仅在接种伤口处出现黑褐色的氧化斑点,随着时间的增加,氧化斑点没有增大。图 4–2 和图 4–3 为接菌叶片,接菌 2 d 后,叶片泛黄,出现水化现象,接菌口处开始出现黑斑,病斑直径 3.0~3.5 mm;接菌 5 d 后,叶片变得透明,全化水,黑斑覆盖整张叶片,叶片上出现黑褐色小点(病征)。将接种发病的青星美人叶片再次进行分离鉴定,获得的菌株与原接种菌株一致,可判定青星美人黑腐病的致病菌为暹罗炭疽菌 (C. siamense)。
2.3 青星美人黑腐病菌的生物学特性
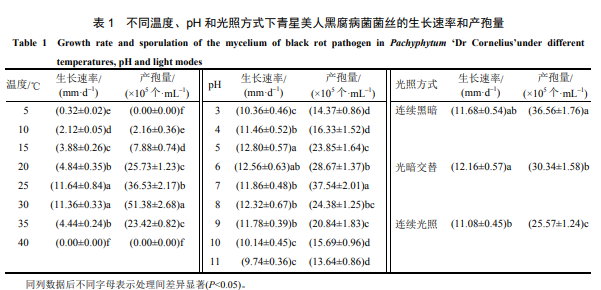
2.3.1 温度、pH 和光照方式对菌丝生长和产孢数量的影响
由表 1 可知,不同温度对青星美人黑腐病菌的菌丝生长和产孢量有影响,5~35 ℃时,菌丝均能生长,25 ℃和 30 ℃时菌丝生长速率较大,分别比 10 ℃ 时的菌丝生长速率提高了 449.06%和 435.85%,显著高于其他温度下的菌丝生长速率;10~35 ℃时,病菌均能产孢,最适产孢温度为 30 ℃,其产孢量比 10 ℃时的产孢量增加了 2278.70%,显著大于其他温度下的产孢量。5 ℃时,菌丝生长极其缓慢,比 10 ℃ 时的菌丝生长速率减少了 84.91%,停止产孢;40 ℃ 时,菌丝死亡,停止产孢。
菌丝在 pH3~11 的培养基上均能较好生长,pH 值为 11 时,菌丝生长速率最小,pH 值为 5 时菌丝生长速率最大,比 pH 为 11 时的菌丝生长速率提高了 31.42%,与 pH 值为 6 时的菌丝生长速率无显著差异,但显著高于其他 pH 下的菌丝生长速率。pH 值为 11 时产孢量最小,pH 值为 7 时产孢量最高,比 pH11 时的产孢量增加了 175.22%,显著高于其他 pH 下的产孢量。
连续光照方式下菌丝的生长速率和产孢量最低,光暗交替方式下菌丝生长速率最大,比连续光照方式下的菌丝生长速率增加了 9.75%,但与连续黑暗下的菌丝生长速率无显著差异;3 种光照条件下的产孢量存在显著差异,连续黑暗最适合产孢,产孢量比连续光照方式下的产孢量提高了 42.98%。
2.3.2 碳源和氮源对菌丝生长和产孢量的影响
由表 2 可知,不同碳源培养基上的菌丝生长速率均显著大于对照,以麦芽糖和蔗糖为碳源的菌丝生长速率较大,分别比对照增加了 40.70%和 38.67%,显著大于木糖醇和葡萄糖,与可溶性淀粉和 D–果糖之间无显著差异;不同碳源培养基上的产孢量均显著大于对照,麦芽糖为最适产孢碳源,产孢量比对照增加了 71.36%,显著高于其他碳源。
以硫酸铵为氮源的菌丝生长速率和产孢量显著小于对照,分别比对照减少了 17.29%和 19.94%;酵母浸膏为菌丝生长最适氮源,其菌丝生长速率比对照增加了 32.82%,与蛋白胨之间无显著差异,但显著大于其他氮源;蛋白胨为最适产孢氮源,其产孢量比对照增加了 60.31%,显著高于其他氮源的。
3 结论和讨论
本研究结果表明,江苏省宿迁市耿车镇多肉植物种植基地青星美人黑腐病致病菌为暹罗炭疽菌(C. siamense)。该病害主要发病期为 5—9 月,病原菌对酸碱环境的适应性都较强,连续光照可有效抑制病害发生,硫酸铵对菌丝生长和产孢有抑制作用。
暹罗炭疽菌是胶孢炭疽菌(C. gloeosporioides) 复合种之一,最早于 2009 年在泰国咖啡上被发现,可引发咖啡炭疽病[13],随后大量由暹罗炭疽菌侵染植物引发病害的相关报道,如杨友联等[8]认为,暹罗炭疽菌可以引起水果采摘后的炭疽病;李沛利等[14] 认为,暹罗炭疽菌可引起鹅掌柴炭疽病;李河等[15] 认为,暹罗炭疽菌可引起油茶苗圃炭疽病;韩晓勇等[16]报道,暹罗炭疽菌可引起紫山药炭疽病,另有国外学者报道暹罗炭疽菌可引起刺桐、山药和辣椒等植物的炭疽病[17–19]。从这些报道可知暹罗炭疽菌侵染植物引起的病害为炭疽病,但笔者发现暹罗炭疽菌侵染多肉植物青星美人可引发黑腐病。刘丽萍等[20]认为,炭疽菌属病原菌在致病过程中形成附着胞的同时,会合成一种次生代谢物质——黑色素。
黑色素除了影响病菌的致病力外,还会使植物叶片黑化[21–22]。罗敦文[23]发现,暹罗炭疽菌能够引起疲萝蜜‘琼引号’幼果蒂腐烂病。刘丽萍等[20]认为,炭疽菌属病原真菌属于半活体营养寄生物,而在侵入寄主植物前期,并不立即杀死植物,营活体营养寄生;在入侵后期,随着侵染菌丝的蔓延,杀死植物,营死体营养寄生。由此可知,暹罗炭疽菌在侵染植物后会导致植物发黑、腐烂、死亡,所以暹罗炭疽菌在侵染青星美人初期叶片黄化,随着病菌在植株体内大量繁殖后导致叶片开始出现发黑、腐烂、死亡等症状。姚锦爱等[4]研究表明,常引起植物叶片褐斑病的山扁豆生棒孢菌也可引发多肉植物的黑腐病,该结果与本研究结果都属于病原菌侵染多肉植物引起非典型性症状病害案例,这可能与多肉植物叶片肥厚、肉质多汁且含水量大等特点有关。暹罗炭疽菌侵染青星美人引发黑腐病的致病机理还需要进一步研究。
本研究结果显示,10~35 ℃时,青星美人黑腐病病原菌暹罗炭疽菌菌丝生长和产孢均正常,5 ℃ 时菌丝生长极其缓慢,停止产孢,40 ℃时菌丝死亡,停止产孢。最适菌丝生长和产孢的温度为 30 ℃,这与苗曦予[24]的研究结果一致,说明青星美人黑腐病最适的发病气温为 25~30 ℃,江苏省宿迁 5—9 月的气温恰好与青星美人黑腐病发生适宜气温耦合。青星美人黑腐病病原菌暹罗炭疽菌对 pH 的适应范围较广,pH 值 3~11 时,菌丝生长良好,pH 值 5 时,菌丝生长速率最大;pH 值 5~9 时,产孢量较大,pH 值 7 时,产孢量最大,该结果与李杨[9] 从海南省油茶及其林下植物上分离出的暹罗炭疽菌在 pH 值 4~11 菌丝生长良好的结果相似,可见青星美人黑腐病菌对酸碱环境的适应性较强。适合青星美人黑腐病病原菌暹罗炭疽菌菌丝生长和产孢的最佳碳源为麦芽糖,最佳氮源为蛋白胨,硫酸铵对菌丝生长和产孢有抑制作用,光暗交替适合菌丝生长,连续黑暗更适合病原菌产孢,但苗曦予[24] 研究认为,兰屿肉桂炭疽病病原菌暹罗炭疽菌最适菌丝生长和产孢氮源为蛋白胨,最适菌丝生长碳源为 α–乳糖,最佳产孢碳源为葡萄糖,连续黑暗适合菌丝生长,光暗交替适合产孢,这可能是因为不同寄主植株、不同地理来源、同种菌株的生态适应性不同[25]的缘故。——论文作者:王芳,王晓立,韩浩章,张颖,张丽华
参考文献:
[1] 张靖瑶,朱煜,赵伟,等.多肉青星美人叶片扦插繁殖体系初探[J].现代园艺,2019(21):24–26. ZHANG J Y,ZHU Y,ZHAO W,et al.Preliminary study on the leaf cutting propagation system of succulent plant Pachyphytum ‘Dr Cornelius’[J].Xiandai Horticulture, 2019(21):24–26.
[2] 王贝贝.景天根际促生菌的筛选、基因组测序及培养基优化[D].泰安:山东农业大学,2018. WANG B B . Screening , genome sequencing and optimization of medium and of PGPR from the rhizosophere of Crassulaceae plants[D].Tai’an,China: Shandong Agricultural University,2018.
[3] 刘浩,杨爽,田佩玉,等.多肉植物彩虹黑腐病病原菌的分离鉴定[C]//彭友良.中国植物病理学会 2019 年学术年会论文集.北京:中国农业科学技术出版社, 2019:199. LIU H,YANG S,TIAN P Y,et al.Isolation and identification of the pathogen of succulent rainbow black rot[C]//PENG Y L.Proceedings of the 2019 Annual Meeting of the Chinese Society of Plant Pathology. Beijing:China Agricultural Science and Technology Press,2019:199.
[4] 姚锦爱,黄鹏,陈汉鑫,等.多肉植物翡翠景天黑腐病病原菌[J].菌物学报,2020,39(2):452–456. YAO J A,HUANG P,CHEN H X,et al.Black rot pathogen of succulent plant Sedum morganianum[J]. Mycosystema,2020,39(2):452–456.
[5] 方中达.植病研究方法[M].3 版.北京:中国农业出版社,1998. FANG Z D.Plant Disease Research Method[M].The third edition.Beijing:China Agricultural Press,1998.
[6] 李戌清,严建立,阮松林.三叶青炭疽病病原菌的鉴定与生物学特性[J].浙江农业学报,2020,32(11): 2009–2019. LI X Q,YAN J L,RUAN S L.Identification and biological characteristics of anthracnose pathogen on Tetrastigma hemsleyanum[J].Acta Agriculturae Zhejiangensis,2020,32(11):2009–2019.
声明:①文献来自知网、维普、万方等检索数据库,说明本文献已经发表见刊,恭喜作者.②如果您是作者且不想本平台展示文献信息,可联系学术顾问予以删除.

SCISSCIAHCI