0
发表咨询在线!

发布时间:2022-03-26所属分类:农业论文浏览:1867次
摘 要: 摘要:在固定床吸附反应器内对一种商业活性炭进行了汞吸附实验,考察了入口汞浓度和吸附温度对活性炭吸附汞的影响。采用 4 个简化的吸附动力学模型,即内扩散模型、准一阶和准二阶动力学模型,耶洛维奇(Elovich)模型从动力学的角度探讨了入口汞浓度和吸附温度对汞吸附

摘要:在固定床吸附反应器内对一种商业活性炭进行了汞吸附实验,考察了入口汞浓度和吸附温度对活性炭吸附汞的影响。采用 4 个简化的吸附动力学模型,即内扩散模型、准一阶和准二阶动力学模型,耶洛维奇(Elovich)模型从动力学的角度探讨了入口汞浓度和吸附温度对汞吸附的影响机制。分析了汞吸附过程的机制和控制过程。结果表明:入口汞浓度的增加,或者吸附温度的降低,均有利于活性炭对汞的吸附,其主要原因是提高了颗粒内扩散速率、初始吸附速率以及准一级反应速率。汞吸附过程主要由化学吸附控制,主要分为表面吸附和内扩散吸附 2 个阶段,初始吸附阶段呈现较快吸附速率,该阶段和表面吸附有关;随着表面活性位被占据,颗粒内扩散起主要控制作用,吸附速率下降。
关键词:活性炭;汞吸附;动力学模型;控制过程;吸附机制
0 引言
汞是一种具有生物累积性,剧毒性及在环境中持久性的污染物[1]。燃煤是全球最大的人为汞排放源[2]。燃煤锅炉烟气中的汞主要以 3 种形态存在:单质汞 Hg0 (g)、氧化态汞 Hg2+ (g)和颗粒态汞 Hg(p)[3]。其中氧化态汞 Hg2+ (g)可以被湿法脱硫装置除去,颗粒态汞 Hg(p)可以被颗粒物控制装置除去,而烟气中的单质汞 Hg0 (g)由于其难溶性及难以被飞灰颗粒吸附而无法脱除,直接排放到大气中危害人类健康。目前最为成熟可行的汞污染控制技术是烟道活性炭喷射技术[4],其原理是向烟道中喷入活性炭,活性炭在流动过程中不断吸附烟气中的汞,将气态汞转化为颗粒态汞,然后利用颗粒物控制装置如布袋除尘器(fabric filter,FF)或静电除尘器 (electrostatic precipitator,ESP)将其脱除。脱汞效率取决于活性炭吸附汞的能力以及汞在活性炭表面的吸附速率。汞的吸附包括 3 个过程:烟气中的汞扩散到吸附剂表面,汞内扩散到活性炭内部的活性位点,活性位点对汞进行吸附[5]。活性炭表面的汞吸附速率由吸附过程中最慢的一步控制,吸附速率可以用动力学方法进行求解。
吸附反应动力学已成为研究吸附过程和吸附机制的一个重要手段,它可以较好的描述吸附过程,预测吸附速率控制步和吸附机制。常用的吸附动力学模型主要包括源于质量平衡方程,分别描述内部扩散和外部传质过程的颗粒内扩散模型 (Weber 和 Morris 模型)和准一阶动力学模型;分别基于 Langmuir 吸附等温方程和 Temkin 吸附等温方程,主要描述化学吸附过程的准二阶动力学模型和 Elovich 模型[6];及常用来描述孔道扩散机制的班厄姆(Bangham)模型[7]。目前,汞在活性炭表面的吸附动力学研究,特别是对于烟气中气态单质汞在活性炭表面的吸附动力学研究报导较少。高洪亮[8]等研究了模拟燃煤烟气中汞在活性炭表面上的吸附反应动力学,发现汞吸附符合一级反应动力学方程,吸附速率常数与吸附温度成负相关。Skodras G[6]利用 Fick 内扩散模型,准一阶与准二阶,及 Elovich 这 4 种吸附动力学模型,研究了汞在活性炭表面的吸附动力学和吸附控制过程,发现汞吸附过程主要由化学吸附控制。Vidic R D[9]研究了硫改性活性炭吸附单质汞的动力学,发现硫化汞(HgS)的生成速率是整个吸附过程的速率控制步。目前,活性炭对单质汞的吸附研究已成为热点[2,10-13],掌握活性炭吸附单质汞的机制及影响汞吸附速率的因素对提高汞吸附效率非常重要。进行单质汞在活性炭表面的吸附动力学研究具有重要的理论意义和应用价值。
本文在固定床吸附反应器内进行一种商业活性炭吸附单质汞的实验,考察入口汞浓度和吸附温度对活性炭吸附汞的影响。采用 4 个简化的吸附动力学模型,即内扩散模型(Weber 和 Morris 模型)、准一阶和准二阶动力学模型,耶洛维奇(Elovich)动力学模型从动力学的角度探讨了入口汞浓度和吸附温度对汞吸附的影响机制,并结合实验研究了汞在活性炭表面的吸附过程动力学机制、吸附速率以及控制过程。
1 实验
实验选取了一种商业活性炭(activated carbon, AC),将 AC 破碎后,标准网筛过筛,选取约 180~ 200 目的粉末。采用美国 Micrometritics 公司生产的 ASAP2020M 型全自动比表面积及孔隙度分析仪对活性炭 AC 样品进行 N2 吸附/脱附,以测定活性炭的比表面积和微孔数据。
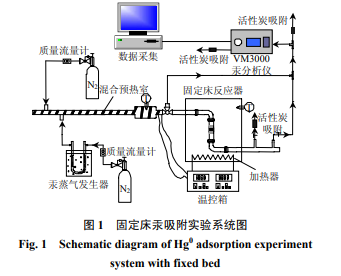
固定床汞吸附实验装置系统如图 1 所示,主要由高纯氮气、汞发生装置、固定床反应器、温控装置和测汞仪等组成,汞蒸气由置于 U 形高硼硅玻璃管内的汞渗透管(VICI Metronics 公司,美国)产生, U 形高硼硅玻璃管置于数控恒温水浴锅中,初始汞蒸气的浓度由载气的流量和水浴温度共同确定。
实验所用的在线测汞仪型号为 VM3000 (Mercury Instruments,德国)。在实验过程中,测汞仪每隔 1 s 测量一次汞浓度,每隔 2 min 仪器自动校零。实验数据采集由计算机自动完成。
在上述固定床汞吸附实验台上,进行了 N2 气氛下商业活性炭 AC 吸附 Hg0的实验,总气体流量为 2 L/min,其中载汞 N2 流量为 150 mL/min。
2 结果与讨论
2.1 吸附剂孔结构特性
图 2 为实验所用 AC 样品在 −195.8℃下的 N2 吸附等温线,从图中可以看出 AC 呈现 I 型等温线 (按照国际纯粹与应用化学联合会的分类)。I 型等温线的线型具有微孔填充特征,其特点是在低相对压力下吸附体积迅速上升,随后为一平坦阶段,最后达到一极限值或渐进地接近直线 p/p0 = 1。吸附等温线在低分压条件下,吸附体积的增长代表样品中存在微孔,在较高分压下,等温线的吸附体积增长代表样品中存在一定数量的中孔和大孔[14]。图 2 表明 AC 微孔数量多,体现出微孔吸附剂特征。根据氮气吸附等温线,通过 BET 方程计算得到样品的比表面积,利用 t-plot 方法得到样品的微孔数据,实验结果见表 1。从表中看出微孔值较大,这与吸附等温线的结果相吻合。
2.2 汞吸附实验
活性炭的汞吸附能力用某时刻汞吸附效率和单位汞吸附量来表征,吸附效率用穿透曲线来表示。
单位汞吸附量(μg/g)定义为:从吸附开始到 t 时刻为止,单位质量吸附剂吸附的汞质量,其表达式详见文献[15]。
实验条件:N2 气氛,吸附剂为 50 mgAC 与 500 mgSiO2 的均匀混合物。工况参数:在吸附温度 150 ℃下,入口汞浓度分别为 18.0、28.1、41.1 μg/g;在入口汞浓度为 33.5 μg/g 时,温度分别为 50、100、 150 ℃。
本文来源于:《中国电机工程学报》(旬刊)是中国电力行业的一流学术期刊,主要报道电力系统及其自动化、发电及动力工程、电工电机领域的新理论、新方法、新技术、新成果。设有:学术论文、新技术、新成果、新经验、专家论坛、专家建议、标准讨论、科学通报、国外科技动态、会议报告等栏目。
图 3 和图 4 分别为 AC 在吸附温度 150 ℃、不同入口汞浓度时的穿透曲线和单位汞吸附量。从图 3 可以看出,入口汞浓度的增加降低了汞穿透率,即增加了汞脱除率。图 4 中,汞吸附量曲线上任意点的切线斜率为对应该时刻的汞吸附速率,“凸” 形吸附量曲线表明初始阶段,吸附速率较快,随吸附的进行,吸附速率不断降低。从图 4 也可以看出,入口汞浓度的增加,吸附剂的单位汞吸附量也增加了。入口汞浓度的增加有利于活性炭对汞的吸附。
图 5 和图 6 分别为 AC 在入口汞浓度 33.5 μg/g、不同温度时的穿透曲线和单位汞吸附量,从图 5 可以看出,相同入口汞浓度时,温度的升高增加了汞穿透率,即降低了汞脱除率。从图 6 可以看出,汞吸附速率随时间增长不断降低;温度升高,降低了活性炭对汞的吸附量。温度的增加抑制了活性炭对汞的吸附。
2.3 汞吸附的动力学分析
2.3.1 分析方法与误差评价
本文利用内扩散模型、准一阶和准二阶动力学模型,Elovich 动力学模型分别对实验数据进行拟合,从动力学的角度分析入口汞浓度和温度对汞吸附的影响机制,分析它们的动力学参数并进行对比,以得到吸附速率控制步和吸附机制。拟合结果与实验值之间的误差用相关系数 R2 表示,R2 值越大表明模型对吸附过程的描述越接近。为减小实验测试的系统误差,实验都在系统工况参数保持稳定的条件下进行,VM3000 在线测汞仪精度可达 0.1 μg/Nm3 ,误差小于 0.2%。因此根据实验数据获得的实验曲线具有真实性,动力学模型拟合曲线能够反映吸附过程的机制。
2.3.2 颗粒内扩散模型
颗粒内扩散模型常用来分析反应中的控制步骤,求出吸附剂颗粒的内扩散速率常数,确定汞在活性炭上的吸附机制。
表 2 为颗粒内扩散方程拟合得到的参数和相关系数 R2 ,从表中可以看出随着入口汞浓度的减少,温度的升高,颗粒内扩散速率常数不断的降低,内扩散速率常数的降低将会影响汞吸附效率,这与实验得到的结论相吻合。从表 2 也可以看出,随着入口汞浓度的增加和温度的增加,R2 越来越小,这说明当入口汞浓度和温度增加时,内扩散控制作用不断减小。
2.3.3 准一阶动力学模型
活性炭表面的汞吸附过程可以用烟气中气相汞与活性炭吸附点之间的准一阶传质机制来描述。如果实验值能较好的与计算值吻合,即相关系数 R2 越大,则说明吸附过程由外部传质控制[6]。
图 8 为采用非线性回归拟合准一阶模型对不同汞浓度和不同吸附温度的结果,表 3 为准一阶动力学方程拟合得到的参数和相关系数 R2 。从图 8 看出各工况的准一阶动力学模型对实验数据拟合的效果明显好于内扩散模型,表 3 中的相关系数 R2 值均比表 2 中的大,这说明相比内扩散,外部传质对吸附过程的控制作用更加明显。温度的降低,准一级反应的速率常数 k1 呈不断增加的趋势,表明增加入口汞浓度或降低吸附温度,均有利于活性炭对汞的吸附。入口汞浓度增加时,R2 值减小,说明随着入口汞浓度的增加,外部传质控制对吸附过程的控制作用减小。而吸附温度增加时,R2 保持不变,说明温度变化对于外部传质控制基本没有影响。
2.3.4 准二阶动力学模型
准二阶动力学模型中,速度控制步是化学吸附,动力学模型基于 Langmuir 吸附等温方程。
从表 4 也可以看出,所有工况的相关系数 R2 均在 0.998 以上。说明尽管传质限制与内扩散限制影响整个汞的吸附,但是化学吸附速率更慢,是汞脱除过程中的控制步,该结论与 Skodras G[6]所得到的结论一致。
从表中也可看出增加入口汞浓度可以增加初始吸附速率;温度增加时,初始吸附速率不断的降低,说明初始吸附速率对温度也较敏感。准二阶动力学模型基于 Langmuir 吸附等温方程,说明汞在活性炭表面的吸附遵循 Langmuir 吸附等温方程[8]。
2.3.5 耶洛维奇(Elovich)动力学模型
Elovich 表面反应动力学模型基于 Temkin 等温方程,常用于描述气体在固体表面的化学吸附过程。
从表 5 还可以看出,利用 Elovich 方程拟合出的初始吸附速率 a 值与准二阶动力学方程拟合得到的初始吸附速率值 k2qe 2非常相近,说明了拟合结果的正确性,得到的初始吸附速率变化情况与准二阶动力学方程拟合结果一致。在不同温度下,与表面覆盖度和活化能有关的常数 b 变化很小,即:汞在活性炭表面的吸附活化能几乎不随温度变化[16]。 Elovich 方程是基于 Temkin 吸附等温方程,而 Elovich 方程所拟合的值与实验值非常接近,说明汞在活性炭表面的吸附遵循 Temkin 吸附等温方程。
3 结论
采用 4 种简化的吸附动力学模型,即内扩散模型、准一阶和准二阶动力学模型,耶洛维奇(Elovich) 模型,对固定床活性炭汞吸附实验结果进行了理论分析,得到如下结论:
1)入口汞浓度增加时,颗粒内扩散速率、初始吸附速率与准一级反应速率均提高,促进了外部传质和内部扩散,有利于活性炭对汞的吸附。温度增加时,颗粒内扩散速率常数、准一级反应速率常数、初始吸附速率有所降低,抑制了粒内扩散,不利于活性炭对汞的吸附。
2)汞的吸附主要分为表面吸附和内扩散吸附 2 个阶段,吸附初始阶段主要呈现表面吸附,活性炭表面有大量的活性位,吸附速率较快;随着表面活性位被占据,吸附进入第二阶段即孔道内扩散吸附,颗粒内扩散起主要作用,吸附速率降低。
3)准二阶动力学模型和 Elovich 方程能够更精确地描述吸附过程,说明化学吸附是汞吸附过程中的控制步。汞在活性炭表面的吸附遵循 Langmuir 吸附等温方程和 Temkin 吸附等温方程。内扩散模型和一阶动力学模型对实验结果的较好拟合也表明传质控制与内扩散控制也影响汞吸附的整个过程,其中传质的控制作用大于内扩散控制。——论文作者:周强,段钰锋,冒咏秋,朱纯
参考文献
[1] Bose O’Reilly S,Lettmeier B,Gothe R M,et al.Mercury as a serious health hazard for children in gold mining areas[J].Environmental Research,2008,107(1):89-97.
[2] 任建莉,周劲松,骆仲泱,等.新型吸附剂脱除烟气中气态汞的试验研究[J].中国电机工程学报,2007,27(2): 48-53. Ren Jianli,Zhou Jinsong,Luo Zhongyang,et al.The application of novel sorbents for mercury vapor removal from simulated flue gases[J].Proceedings of the CSEE, 2007,27(2):48-53(in Chinese).
[3] Martinez A I,Deshpande B K,et al.Kinetic modeling of H2O2-enhanced oxidation of flue gas elemental mercury[J].Fuel Process Technology,2007,88(10): 982-987.
[4] Lee S H,Rhim Y J,Cho S P,et al.Carbon-based novel sorbent for removing gas-phase mercury[J].Fuel,2006, 85(2):219-226.
[5] Serre S D,Gullett B K,Ghorishi S B,et al.Entrained-flow adsorption of mercury using activated carbon[J].Air & Waste Management Association,2001,51(5):733-741.
[6] Skodras G,Diamantopoulou I,Pantoleontos G,et al. Kinetic studies of elemental mercury adsorption in activated carbon fixed bed reactor[J] . Journal of Hazardous Materials,2008,158(1):1-13.
[7] 李兵,蒋海涛,张立强,等.SO2在活性炭表面的吸附平衡和吸附动力学[J].煤炭学报,2012,37(10): 1737-1742. Li Bing,Jiang Haitao,Zhang Liqiang,et al.Adsorption equilibrium and kinetics of SO2 on activated carbon[J]. Journal of China Coal Society , 2012 , 37(10) : 1737-1742(in Chinese).
[8] 高洪亮,周劲松,骆仲泱,等.模拟燃煤烟气中汞在活性炭上吸附的动力学研究[J].中原工学院学报,2005, 16(6):1-5. Gao Hongliang,Zhou Jinsong,Luo Zhongyang,et al. Kinetic studies of mercury adsorption on activated carbon in simulated flue gas[J].Journal of Zhong Yuan Institute of Technology,2005,16(6):1-5(in Chinese).
[9] Vidic R D,Chang M T,Thurnau R C,et al.Kinetics of vapor-phase mercury uptake by virgin and sulfurimpregnated activated carbons[J] . Air & Waste Management Association,1998,48(3):247-255.
[10] 赵鹏飞,郭欣,郑楚光,等.载银稻壳基吸附剂的制备与表征及其脱除 Hg0 的实验研究[J].中国电机工程学报,2012,32(5):61-67. Zhao Pengfei,GuoXin,Zhen Chuguan,et al.Synthesis and characterizations of silver-loaded rice husk ash sorbents and their performance for elemental mercury removal[J].Proceedings of the CSEE,2012,32(5): 61-67(in Chinese).
声明:①文献来自知网、维普、万方等检索数据库,说明本文献已经发表见刊,恭喜作者.②如果您是作者且不想本平台展示文献信息,可联系学术顾问予以删除.

SCISSCIAHCI