发布时间:2020-02-25所属分类:医学职称论文浏览:1次
摘 要: 摘要背景:前期研究观察到神经干细胞新分化的神经元表达甲酰基肽受体 2,并证实甲酰基肽受体 2 能促进神经干/祖细胞迁移,诱导向神经元分化。脊髓损伤组织中存在甲酰基肽受体 2 配体,然而不同的配体与甲酰基肽受体 2 结合可能导致不同、甚至相反的生物学效
摘要背景:前期研究观察到神经干细胞新分化的神经元表达甲酰基肽受体 2,并证实甲酰基肽受体 2 能促进神经干/祖细胞迁移,诱导向神经元分化。脊髓损伤组织中存在甲酰基肽受体 2 配体,然而不同的配体与甲酰基肽受体 2 结合可能导致不同、甚至相反的生物学效应。
目的:探讨脊髓损伤产生的配体与甲酰基肽受体 2 作用后对神经元突起生长的影响。
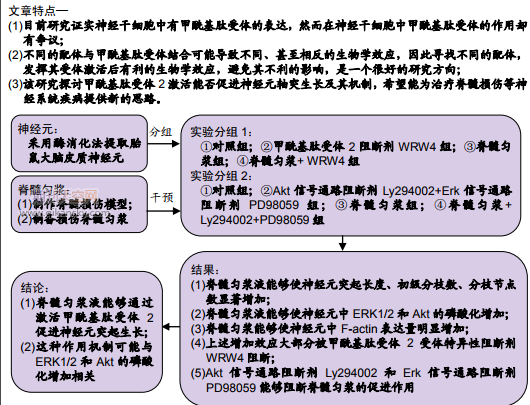
方法:采用酶消化法提取胎鼠大脑皮质神经元;制备 SD 大鼠脊髓损伤模型,提取损伤脊髓组织匀浆。①实验分组 1:观察甲酰基肽受体 2 激活对神经元突起的影响,分组如下:对照组、甲酰基肽受体 2 阻断剂组(即添加 WRW4)、脊髓匀浆组、脊髓匀浆+WRW4 组;②实验分组 2:观察甲酰基肽受体 2 激活后 AKT 和 ERK 信号通路阻断对神经元突起的影响,分组如下:对照组、AKT 和 ERK 信号通路阻断剂组(即添加 Ly294002+PD98059)、脊髓匀浆组、脊髓匀浆+Ly294002+PD98059 组。神经元细胞贴壁 24 h 后,按上述分组处理 7 d,免疫荧光染色共聚焦显微镜观察脊髓匀浆激活甲酰基肽受体 2 对神经元突起的影响;按上述分组处理 30 min,Western blotting 检测磷酸化蛋白水平;按上述分组处理 24 h,Western blotting 检测 F-actin 水平,观察在甲酰基肽受体 2 特异性阻断剂 WRW4 存在的情况下,对 MAPK 和 PI3K/Akt 通路中关键蛋白磷酸化的影响。
结果与结论:①脊髓损伤组织匀浆液能够使神经元突起长度、初级分枝数、分枝节点数显著增加,这种增加效应大部分被甲酰基肽受体 2 受体特异性阻断剂 WRW4 阻断;②脊髓损伤组织匀浆液能够使神经元中 ERK1/2 和 Akt 的磷酸化增加,这种效应能够被 WRW4 阻断; ③Akt 信号通路阻断剂 Ly294002 和 Erk 信号通路阻断剂 PD98059 能够阻断脊髓匀浆的促进作用;④脊髓损伤组织匀浆能够使 F-actin 表达量明显增加,这种效应能够被甲酰基肽受体 2 特异性阻断剂 WRW4 所阻断;⑤这些实验结果说明,脊髓匀浆液能够通过激活甲酰基肽受体 2 促进神经元突起生长,这种作用机制可能与 ERK1/2 和 Akt 的磷酸化增加相关。
关键词:脊髓损伤;脊髓损伤组织匀浆;神经元;甲酰基肽受体;轴突生长;Akt 信号通路;Erk 信号通路
0 引言
Introduction 脊髓损伤具有发病率高、死亡率低等特点,给患者身心健康、家庭经济负担和社会医疗带来了巨大的压力。因此,加强脊髓损伤神经功能修复的基础及临床研究具有重大意义。
脊髓损伤后,损伤平面上下之间的物理联系(即下行运动轴突和上行感觉轴突的损伤)中断,导致脊髓信息传递功能受阻,使得损伤平面以下感觉和运动障碍。轴突再生并与靶细胞形成突触联系是修复脊髓信息传递功能的关键之一。
相关知识推荐:医疗技术方面论文有哪些征稿期刊
轴突再生机制非常复杂,受众多因素的调节和影响。中枢神经系统损伤、缺血等病理情况下产生许多种类的因子,在轴突再生过程中发挥重要的作用,如神经营养因子、炎症因子、趋化因子等。近年来,趋化因子及其受体对轴突再生的作用逐渐成为研究的热点[1-4]。甲酰基肽受体 (formyl peptide receptors,FPRs)是化学性趋化因子受体。前期研究观察到神经干细胞表达甲酰基肽受体2,并证实甲酰基肽受体2能促进神经干/祖细胞迁移,诱导向神经元分化[5]。国内外研究证实神经元也表达甲酰基肽受体[5-7]。该研究拟进一步探讨甲酰基肽受体2激活能否促进神经元轴突生长及其机制,希望能为治疗脊髓损伤等神经系统疾病提供新的思路。
1 材料和方法 Materials and methods
1.1 设计 细胞学实验。
1.2 时间及地点 实验于2016年1至10月在陆军军医大学附属第二医院中心实验室完成。
1.3 材料
1.3.1 实验动物 SPF级12.5 d龄SD孕鼠(提取胎鼠大脑皮质神经元),10只SPF级雄性SD大鼠10只(制备脊髓匀浆,2月龄,体质量200-250 g),由中国人民解放军特色医学中心实验动物中心提供。所有有关实验动物的操作均按国际通用实验室动物使用指南和解放军陆军军医大学动物实验管理使用规定执行,以最大限度减少实验动物用量及减轻实验动物痛苦。
1.3.2 实验药品与试剂 p-Akt、Akt、p-Erk、Erk、p-p38、 p38、F-actin、β-Ⅲ tubulin一抗(Abcam公司);GAPDH一抗(碧云天生物技术公司);甲酰基肽受体2受体特异性阻断剂WRW4(Tocris公司);DMEM/F12、优质胎牛血清、 Accutase消化液(Gibco公司);Neurobasal培养基(Life Technologies);Akt信号通路阻断剂Ly294002、ERK1/2 信号通路阻断剂PD98059(Sigma公司);多聚鸟氨酸及其他未注明来源的试剂(Sigma公司)。
1.3.3 实验器材 低温离心机、酶标仪(美国Thermo scientific公司);激光共聚集显微镜(德国Carl Zeiss公司);倒置显微镜(日本Olympus公司);37 ℃含体积分数为 5%CO2孵育箱(美国Thermo Forma公司);Western Blot 电泳仪、转膜仪(北京六一仪器厂)。
1.4 实验方法
1.4.1 神经元培养 采用酶消化法提取胎鼠大脑皮质神经元。简述如下:以颈椎脱臼方法处死孕12.5 d SD大鼠,取出胎鼠,分离出大脑皮质,剥除脑膜,用眼科剪将组织块剪碎。加入适量0.25%胰蛋白酶,于37 ℃消化12 min,用2倍体积含体积分数为10%胎牛血清的DMEM/F12终止消化,巴氏吸管轻轻吹打,取出上清,将没有消化的组织块重复上面步骤再次消化和终止消化,直至组织块完全消化。将每次收集的上清以100 μm细胞过滤器进行过滤,离心(1 000 r/min, 5 min)后,用含有B27(2%)、谷氨酰胺(0.5 mmol/L)的 Neurobasal培养基重悬,置于37 ℃恒温培养箱培养。 。
1.4.2 脊髓匀浆的制备 根据Fehlings的方法制作脊髓损伤模型[21-22]。简述如下:10只SPF级SD大鼠,5%水合氯醛按350 mg/kg行腹腔麻醉,固定于小动物手术台上。纵向切开背部皮肤,切口长约1 cm,钝性分离颈后脂肪垫。注意避免损伤该处大静脉,防止大出血。暴露棘突和椎板,确定T10,T11椎体位置。用文氏钳小心咬去T10棘突及相应椎板,充分暴露脊髓。采用小号动脉夹,钳夹脊髓30 s, 损伤脊髓。钳夹完毕后,用生理盐水冲洗伤口,无菌缝合。术后第2天,无菌条件下取损伤处脊髓节段约1 cm×1 cm,加入5 mL DPBS进行匀浆,匀浆液12 000 r/min离心5 min,收集上清液即为脊髓匀浆,上清液-70 ℃保存备用
1.4.3 实验分组 ①观察甲酰基肽受体2激活对神经元突起的影响,分组如下:对照组、甲酰基肽受体2阻断剂组(即添加WRW4)、脊髓匀浆组、脊髓匀浆+WRW4组;②观察甲酰基肽受体2激活后AKT和ERK信号通路阻断对神经元突起的影响,分组如下:对照组、AKT和ERK信号通路阻断剂组(即添加Ly294002+PD98059)、脊髓匀浆组、脊髓匀浆+Ly294002+PD98059组。
1.4.4 免疫荧光染色及共聚焦显微镜观察 细胞贴壁 24 h后,分别给予脊髓匀浆、相应阻断剂处理。在添加脊髓匀浆之前30 min,分别添加WRW4(终浓度0.4 μmol/L) 或 Ly294002( 终浓度 10 μmol/L)+PD98059( 终浓度 10 μmol/L),作用7 d后,进行神经元细胞标志物(β-Ⅲ tubulin)抗体免疫荧光染色。简述步骤如下:加入20 g/L多聚甲醛室温固定15 min,0.5% Triton X-100透膜15 min,血清封闭1 h,4 ℃一抗孵育过夜,室温二抗孵育2 h,DAPI 复染5 min,激光共聚焦显微镜成像分析。在每高倍镜视野中计数神经元数量,测量神经元分枝的长度,计数初级分枝数、分枝节点数。
1.4.5 Western blotting实验 各组细胞作用30 min后,测量磷酸化蛋白水平,各组细胞作用24 h后,测量F-actin水平。提取神经元总蛋白,BCA法测定蛋白浓度;取等量蛋白(50 μg),上样,电泳,转膜,5%脱脂奶粉封闭2 h;p-Akt、 Akt、p-Erk、Erk、p-p38、p38、F-actin抗体(1∶1 000)、 GAPDH单克隆抗体(1∶5 000) 4 ℃孵育过夜;TBST洗膜 3次,每次10 min,二抗为辣根过氧化物酶标记的山羊抗兔/ 小鼠IgG(1∶5 000)室温孵育2 h,洗膜3次,每次10 min;加显色剂,Chemi Doc XR+凝胶成像仪扫描成像,条带分析测定使用Image Lab程序。
1.5 主要观察指标 ①免疫荧光染色共聚焦显微镜观察神经元突起的长度、初级分枝数、分枝节点数;②Western blotting实验观察神经元经过不同处理后信号通路分子 p-Akt、Akt、p-Erk、Erk、p-p38、p38及细胞骨架分子F-actin 表达。
1.6 统计学分析 采用SPSS 18.0统计学软件,计量资料以x _ ±s表示,进行方差分析,P < 0.05为差异有显著性意义。
1.4.3 实验分组 ①观察甲酰基肽受体2激活对神经元突起的影响,分组如下:对照组、甲酰基肽受体2阻断剂组(即添加WRW4)、脊髓匀浆组、脊髓匀浆+WRW4组;②观察甲酰基肽受体2激活后AKT和ERK信号通路阻断对神经元突起的影响,分组如下:对照组、AKT和ERK信号通路阻断剂组(即添加Ly294002+PD98059)、脊髓匀浆组、脊髓匀浆+Ly294002+PD98059组。
1.4.4 免疫荧光染色及共聚焦显微镜观察 细胞贴壁 24 h后,分别给予脊髓匀浆、相应阻断剂处理。在添加脊髓匀浆之前30 min,分别添加WRW4(终浓度0.4 μmol/L) 或 Ly294002( 终浓度 10 μmol/L)+PD98059( 终浓度 10 μmol/L),作用7 d后,进行神经元细胞标志物(β-Ⅲ tubulin)抗体免疫荧光染色。简述步骤如下:加入20 g/L多聚甲醛室温固定15 min,0.5% Triton X-100透膜15 min,血清封闭1 h,4 ℃一抗孵育过夜,室温二抗孵育2 h,DAPI 复染5 min,激光共聚焦显微镜成像分析。在每高倍镜视野中计数神经元数量,测量神经元分枝的长度,计数初级分枝数、分枝节点数。
1.4.5 Western blotting实验 各组细胞作用30 min后,测量磷酸化蛋白水平,各组细胞作用24 h后,测量F-actin水平。提取神经元总蛋白,BCA法测定蛋白浓度;取等量蛋白(50 μg),上样,电泳,转膜,5%脱脂奶粉封闭2 h;p-Akt、 Akt、p-Erk、Erk、p-p38、p38、F-actin抗体(1∶1 000)、 GAPDH单克隆抗体(1∶5 000) 4 ℃孵育过夜;TBST洗膜 3次,每次10 min,二抗为辣根过氧化物酶标记的山羊抗兔/ 小鼠IgG(1∶5 000)室温孵育2 h,洗膜3次,每次10 min;加显色剂,Chemi Doc XR+凝胶成像仪扫描成像,条带分析测定使用Image Lab程序。
1.5 主要观察指标 ①免疫荧光染色共聚焦显微镜观察神经元突起的长度、初级分枝数、分枝节点数;②Western blotting实验观察神经元经过不同处理后信号通路分子 p-Akt、Akt、p-Erk、Erk、p-p38、p38及细胞骨架分子F-actin 表达。
1.6 统计学分析 采用SPSS 18.0统计学软件,计量资料以x _ ±s表示,进行方差分析,P < 0.05为差异有显著性意义。
2 结果 Results
2.1 大鼠脊髓损伤组织匀浆液通过甲酰基肽受体2促进神经元突起生长 共聚焦显微镜观察结果显示:与对照组相比,匀浆液能够使神经元突起的长度、初级分枝数、分枝节点数显著增加,这种增加效应大部分能够被甲酰基肽受体2受体特异性阻断剂WRW4阻断,见图1。实验结果说明脊髓损伤组织匀浆液能够通过甲酰基肽受体2促进神经元突起生长,同时这种作用具有特异性。
2.2 大鼠脊髓损伤组织匀浆液通过甲酰基肽受体2引起 ERK1/2和Akt的磷酸化 为了探究甲酰基肽受体2激活对轴突生长促进作用的相关信号通路,实验检测了甲酰基肽受体2激活对MAPK和PI3K/Akt通路中关键蛋白磷酸化作用的影响。Western blotting实验结果提示:与对照组相比,脊髓匀浆液能够促使神经元中ERK1/2和Akt的磷酸化,而对MAPK通路中另一关键蛋白p38的磷酸化无明显影响,见图2;相反,利用甲酰基肽受体2受体特异性阻断剂WRW4 进行阻断,发现不论是ERK1/2还是Akt的磷酸化都显著下降。这些实验结果说明,甲酰基肽受体2激活通过磷酸化 ERK1/2和Akt促进轴突生长。
2.3 大鼠脊髓损伤组织匀浆液通过ERK1/2和Akt磷酸化促进神经元突起生长 为了更进一步观察ERK1/2和Akt在甲酰基肽受体2促进神经元突起生长中的作用,又进行了相应的阻断实验。实验结果提示:脊髓匀浆促进神经元突起生 长 的 作 用 , 能 够 被 ERK1/2 和 Akt 信 号 通 路 阻 断 剂 Ly294002和PD98059阻断,见图3。
2.4 大鼠脊髓损伤组织匀浆液通过甲酰基肽受体2引起 F-actin表达量增加 细胞骨架F-actin在神经元突起生长中起着重要的作用,为了进一步探讨甲酰基肽受体2激活促进神经元突起生长的机制,实验观察了甲酰基肽受体2对 F-actin的影响。与对照组相比,脊髓损伤组织匀浆液能够使神经元F-actin表达量显著增加,这种增加效应大部分能够被甲酰基肽受体2受体特异性阻断剂WRW4阻断,见图 4。这些实验结果说明脊髓损伤组织匀浆液能够通过甲酰基肽受体2促进F-actin的表达导致神经元突起生长,同时这种作用具有特异性。
3 讨论 Discussion
甲酰基肽受体是G蛋白偶联受体(GPCR)家族的主要成员,包括甲酰基肽受体1和甲酰基肽受体2,人类还有甲酰基肽受体3 [8-11]。甲酰基肽受体是化学性趋化因子受体,具有多种配体,如fMLP,Annexin A1等[12-14],不同配体与甲酰基肽受体结合可能导致不同、或者相反的生物学效应[15-19]。这些配体存在于损伤或感染的组织中[20-22],在细胞死亡或细胞功能障碍时,细胞中的线粒体可以释放这些配体[23],同时这些配体也可以来源于细菌或病毒蛋白[24-26]。作者在以前的实验中观察到脊髓损伤时能够产生甲酰基肽受体的配体。甲酰基肽受体首先在中性粒细胞、单核细胞中发现[6,27-29],在创伤或感染性炎症中,甲酰基肽受体的激活促进中性粒细胞、单核细胞迁移,增强吞噬作用,提升机体免疫力。近年来,甲酰基肽受体在非吞噬性细胞中的表达和作用也进行了广泛的研究,如间充质干细胞[30]、结肠创面上皮细胞[31]、内皮祖细胞[32]、神经细胞等[33]。
在目前观察到的细胞中,甲酰基肽受体的主要作用是促进细胞迁移。细胞迁移和轴突生长及延伸均由细胞骨架的极性排布而实现,因此甲酰基肽受体理论上具有促进轴突生长及延伸的作用。作者及国内外多家实验室研究证实神经干细胞表达甲酰基肽受体[7,18,34-35]。同时作者前期研究观察到甲酰基肽受体在体内外均能促进脑源性神经干细胞的迁移、分化,神经元表达甲酰基肽受体,并且甲酰基肽受体激活能够促进神经干细胞新分化的神经元触突生长 及突起分枝增多[7]。HO等[36]最近研究发现甲酰基肽受体2 在脑干和脊髓中高水平表达,甲酰基肽受体2抑制剂 PBP10或者WRW4能够抑制神经轴突的生长和抑制突起的形成。KORIMOVá等[6]研究证实许旺细胞中也表达甲酰基肽受体2,并能促进许旺细胞突起的生长,这对于 Wallerian变性后轴突再生十分有利。
该研究进一步研究了脊髓损伤后促进神经元突起生长的作用和机制。采用脊髓损伤后组织匀浆作用于神经元,观察到脊髓匀浆能够促进神经元突起长度、初级分枝数、分枝节点数显著增加,同时这种作用大部分能够被甲酰基肽受体2特异性阻断剂WRW4所阻断,提示甲酰基肽受体2 的激活能够促进神经元突起生长。同时观察到WRW4并不能完全阻断脊髓匀浆的促进作用,提示脊髓匀浆内还有其他因素作用,这可能与脊髓匀浆不是单一成分有关,同时也提示如果要获得促进神经元突起生长的最大效应,需要多因素的综合作用。这些因素之间如何组合才能发挥彼此之间协同效应,这需要进一步研究。
实验结果提示脊髓损伤组织匀浆液能够使神经元中 ERK1/2和Akt的磷酸化,而对MAPK通路中另一关键蛋白 p38的磷酸化无明显影响,利用甲酰基肽受体2受体特异性阻断剂WRW4进行阻断,发现不论是ERK1/2还是Akt的磷酸化都显著下降。同时Akt信号通路阻断剂Ly294002和Erk 信号通路阻断剂PD98059能够阻断脊髓匀浆的促进作用,这些实验结果说明甲酰基肽受体2激活通过磷酸化ERK1/2 和Akt促进轴突生长。在创伤或感染性炎症中,甲酰基肽受体与其配体结合后触发Erk1/2、Junk等多种信号反应并促进炎症细胞迁移,增强吞噬能力以及上调活性氧,从而增强机体免疫能力[32]。
作者前期实验研究证实,甲酰基肽受体2的激活能够导致神经干细胞的迁移增加,可能与F-actin表达量增加有关。 F-actin是细胞骨架重要的分子,不仅与细胞迁移相关,在细胞中还与突起的生长相关,因此进一步观察了脊髓匀浆对F-actin表达影响,结果提示脊髓匀浆能够使F-actin表达量明显增加,这种效应能够被甲酰基肽受体2特异性阻断剂 WRW4所阻断,说明脊髓匀浆能够通过促进F-actin的表达量增加,促进神经元突起的生长。
总之,实验探讨了脊髓损伤产生的配体与甲酰基肽受体2 作用后对神经元突起的影响并初步探索了可能的机制,为明确甲酰基肽受体2在神经发生中的作用提供新的理论基础,也为治疗脊髓损伤或者脑损伤提供新的潜在的治疗靶点。
SCISSCIAHCI