0
留言稍后联系!

发布时间:2019-12-26所属分类:医学论文浏览:1240次
摘 要: 【摘要】目的探索氟西汀对卒中后抑郁(PSD)模型大鼠的行为和海马神经元新生的影响。方法32只成年雄性大鼠随机分成假手术组、卒中组、PSD组和氟西汀组,采用大脑中动脉栓塞方法制备缺血性卒中大鼠模型,慢性不可预见性温和刺激联合孤养法制备PSD大鼠模型。于基

【摘要】目的探索氟西汀对卒中后抑郁(PSD)模型大鼠的行为和海马神经元新生的影响。方法32只成年雄性大鼠随机分成假手术组、卒中组、PSD组和氟西汀组,采用大脑中动脉栓塞方法制备缺血性卒中大鼠模型,慢性不可预见性温和刺激联合孤养法制备PSD大鼠模型。于基线期及术后第7、14、21、28和35天进行体重测量,以及蔗糖偏爱试验和敞箱试验评估大鼠的行为学变化,第35天时增加强迫游泳试验。试验结束时免疫组化检测海马齿状回的神经元新生情况。结果应激开始后28d和35d测大鼠体重、蔗糖水消耗比例、敞箱试验水平运动得分和垂直运动得分,PSD组较卒中组差异均有统计学意义(P<0.05),氟西汀组较PSD组差异也有统计学意义(P<0.05)。与卒中组比较,PSD组大鼠在强迫游泳试验中不动时间显著增加、游泳及攀爬时间显著缩短(P<0.01)。而氟西汀干预后大鼠不动时间较PSD组显著缩短、游泳时间显著增加(P<0.01)。免疫组化显示,与卒中组比较,PSD组大鼠海马齿状回的新生神经元数目显著减少(P<0.01),而氟西汀干预后大鼠海马齿状回的新生神经元数目较PSD组显著增加(P<0.01)。结论氟西汀可有效改善PSD大鼠的抑郁状况,海马神经元再生参与此过程并起重要作用。
【关键词】卒中后抑郁;氟西汀;海马;动物模型
卒中后抑郁(post-strokedepression,PSD)是脑卒中后常见的神经精神并发症,其患病率逐年升高[1],并且至少1/3患者在缺血性脑卒中后会出现心境改变[2]。现代医学认为,PSD是各种神经生物学和社会心理因素综合作用的结果[3-4]。研究发现,抑郁症患者或动物模型存在海马神经元再生减少、海马体积变小,而且抗抑郁药物可以增加海马神经元再生[5],提示海马神经元的再生障碍可能也参与了PSD的发生。本研究将建立PSD大鼠模型,并观察大鼠的行为学变化及其海马齿状回神经元的新生情况,探索氟西汀对PSD模型大鼠的治疗作用及生物学机制。
1材料和方法
1.1实验动物
成年雄性SD大鼠40只(SPF级),体重240~260g,购于湖南省斯莱克景达实验动物有限公司[SCXK(湘)2016-0002],动物实验在湖南省人民医院老年医学研究所动物实验室进行[SYXK(湘)2015-0013]。福利伦理审查号(伦审科2016第006号),按照实验动物使用的3R原则给予人道的关怀。
1.2主要试剂与仪器
盐酸氟西汀购于大连美仑生物技术有限公司(产品编号:MB1555)。MCAO硅胶栓线购于广州佳灵生物技术有限公司(产品规格:L3600)。微小染色体维持蛋白2抗体(Anti-MCM2Antibody)购于武汉博士德生物有限公司(产品编号:BM4086)。
1.3试验方法
1.3.1动物分组
在室温(20±2)℃和相对湿度为50%~60%的条件下适应性饲养大鼠一周,大鼠自由进食和饮水,予以人工12h昼夜循环照明(7:00~19:00光照),隔日定时清洁笼舍。期间测定敞箱试验(openfieldtest,OFT)、蔗糖偏爱试验(sucrosepreferencetest,SPT)基线评分。筛选符合条件(OFT基线评分为30~120分)的大鼠40只随机分成2组:手术组(n=32)和假手术组(n=8)。手术组行大脑中动脉阻塞(middlecerebralarteryocclusion,MCAO)术,术后24h评分≥1分且<4分(按照Longa等[6]标准)的大鼠24只再随机分成3组:卒中组(n=8),每笼3~4只饲养;PSD组(n=8),MCAO术后第2天加以慢性不可预见温和应激(chronicunpredictablemildstress,CUMS)结合独笼饲养;氟西汀组(n=8),MCAO术后第2天即开始CMUS刺激结合独笼饲养,自第15天起每日一次腹腔注射氟西汀(剂量为5mg/kg体重)[7]进行干预,共用药3周。假手术组除不插入栓线外,其他处理同卒中组。
1.3.2PSD模型建立
首先参照Longa等[6]方法建立永久性MCAO模型,术中参照包新杰等[8]研究结果确定插入栓线深度为(18±1)mm。MCAO术后第2天,参照Willner[9]和Katz[10]报道的CUMS方法给予应激:①禁食禁饮20h;②禁饮17h;③45°斜置鼠笼17h;④持续照明17h;⑤湿笼(100g垫料+200mL水)21h;⑥4℃水强迫游泳5min;⑦水平震荡鼠笼5min;⑧行为约束2h;⑨夹尾1min,以上9种应激每天随机采取一种,并采用单笼饲养。
1.3.3行为学评价
各组大鼠术前基线期(0d)及术后第7、14、21、28和35天分别测量体重,并进行SPT和OFT,而强迫游泳试验(forcedswimtest,FST)仅在第35天末次应激后进行。
(1)蔗糖偏爱试验借鉴Willner等方法[9]加以改进。首先予1%蔗糖水饲养48h,再禁水4h,然后暴露1h于两个完全相同的瓶子(一个盛满1%蔗糖水,另一个盛满普通饮用水)。测定此1h内蔗糖水消耗体积与总消耗体积(蔗糖水+饮用水)的比值。
(2)敞箱试验参照Papp等方法[11]所用敞箱长宽均为80cm、高为40cm,内空的立柱体,壁周为黑色,底面用黑线划分为面积相等的25块。以动物穿越地面方块数(四爪跨入)作为水平活动得分,以直立次数(两前肢离地lcm以上)为垂直活动得分,记录5min。室内隔音,每次实验后均需将动物排泄物清除干净。
(3)强迫游泳试验参照Porsolt等方法[12],试验前1天将大鼠笼敞开饲养,第2天将大鼠放入一个盛水[(24±1)℃,45cm深]的圆柱状筒内持续10min,游泳过程用摄像机拍摄记录。观察最初5min,累计大鼠在水中不动、游动或攀爬状态的时间。
1.3.4免疫组化
行为学试验结束后,用10%水合氯醛按3mL/kg体重腹腔注射麻醉大鼠,先后用4℃生理盐水及含1%蔗糖的1%多聚甲醛(PFA)进行灌注,取脑于含1%蔗糖的1%PFA固定3h,再移入4℃30%蔗糖溶液置冰箱中脱水沉底,制备海马冠状位冰冻切片(厚度20μm)。取每只大鼠海马组织结构最清楚的3张冰冻切片进行微小染色体维持蛋白2(minichromosomemaintenancecomplexcomponent2,MCM2)免疫组化染色,在400倍显微镜下,随机选取五个视野,计算每个视野的MCM2阳性细胞数,然后取其平均值。
1.4统计学方法
采用SPSS17.0软件包进行数据统计,计量资料以平均数±标准差(x±s珋)表示,统计方法为单因素方差分析(多组间两两比较采用LSD-t检验)或Kruskal-WallisH检验(方差不齐)。以P<0.05为差异具有统计学意义。
2结果
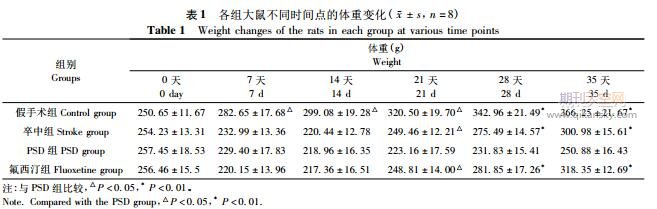
2.1体重的变化
各组大鼠在术前体重基线值无统计学差异(P>0.05)。在实验观察期内,假手术组大鼠体重随饲养时间延长而缓慢增加,而卒中组、PSD组和氟西汀组大鼠体重在手术后前14天内呈下降趋势,自第21天时开始体重逐渐增加,其中卒中组和氟西汀组大鼠的体重增长速度较PSD组大鼠明显增快。与卒中组比较,PSD组大鼠的体重在第21、28和35天时均有统计学差异(P<0.01);与PSD组比较,氟西汀组大鼠的体重在第21、28和35天时均有统计学差异(P<0.01)(见表1)。
2.2蔗糖偏爱试验
各组大鼠蔗糖水消耗比例术前基线水平无统计学差异(P>0.05);MCAO术后第14、21、28、35天时,与卒中组比较,PSD组大鼠蔗糖水消耗比例均显著减少(P<0.01);与PSD组比较,氟西汀组大鼠的蔗糖水消耗比例在第21、28和35天时显著增加(P<0.05)(见表2)。
2.3敞箱试验
各组大鼠术前水平运动评分基线值无统计学差异(P>0.05);与卒中组比较,PSD组大鼠水平运动得分在第21、28和35天时显著下降(P<0.01);与PSD组比较,氟西汀干预后大鼠在第21、28和35天时水平运动得分明显增加(P<0.05)(见表3)。
各组大鼠术前垂直运动评分基线值无统计学差异(P>0.05);与卒中组比较,PSD组大鼠垂直运动得分在第28和35天时明显下降(P<0.05);与PSD组比较,氟西汀干预后大鼠在第28和35天时垂直运动得分显著增加(P<0.05)(见表4)。
2.4强迫游泳试验
与假手术组、卒中组比较,PSD组大鼠的不动时间显著增加(P<0.01),游动及攀爬时间显著缩短(P<0.01);与PSD组相比,氟西汀干预后大鼠不动时间显著缩短(P<0.01),游动时间显著增加(P<0.01)(见表5)。
2.5海马齿状回新生神经元的变化
采用免疫组化方法检测大鼠海马齿状回区MCM2的表达,分析海马中新生神经元增生的变化。结果显示,在大鼠海马结构中,可见MCM2主要表达于细胞核,MCM2阳性细胞局限于颗粒细胞层和门区之间的颗粒细胞下层,一般不会超过颗粒细胞层内1/3(见图1)。与卒中组比较,PSD组大鼠海马齿状回的MCM2阳性细胞数显著减少(H=109.30和P<0.01);与PSD组比较,氟西汀组大鼠海马齿状回的MCM2阳性细胞数显著增加(H=149.74,P<0.01)(见图2)。
3讨论
PSD是脑卒中后出现的一种精神情感障碍,它是卒中后脑部特定功能结构的损伤以及各种心理和社会应激的共同结果。本实验首先通过线栓法制备脑缺血卒中模型,再运用孤养法及CMUS法联合模拟卒中后的负性压力环境制备PSD模型大鼠。该模型广泛应用于PSD发病机制和药物疗效评价研究,其原理是啮齿类动物在经历一系列CMUS应激后,会出现快感缺失、兴趣及运动下降、探索行为下降等抑郁行为特征[13-14]。
相关知识推荐阅读:动物实验论文投什么期刊杂志
动物实验可以给人们生活或者是医学方面带来帮助,也是很多动物学家的重要工作,他们在评定职称时也会发表动物实验论文,然而哪些期刊是能接收这类论文,也是作者们较为关心的问题,毕竟只有选择正确的期刊对于成功投稿才有帮助的,否则论文再好,实验内容再丰富也是不好发表的,为此期刊天空的小编在这里给大家分享了几本动物实验方向的优秀期刊。有投稿需求的,可以联系期刊天空在线编辑。
体重减轻是CMUS模型大鼠的重要特征之一,其原因可能是由于大鼠情感抑郁、食欲下降导致体重增加缓慢,但也可能是应激过程中采用了禁食禁水刺激,直接导致体重增加缓慢[15]。因此,体重的减轻可以反映应激事件对大鼠的负面影响,但不能作为衡量PSD大鼠模型建立是否成功的标准。SPT是根据大鼠对甜味的偏好而设计的一种检测方法,反映了大鼠体验快乐的能力,常用来评价抑郁大鼠的快感缺失症状[9]。OFT是反映大鼠对未知环境的探索能力及情绪反应的经典实验,主要评价抑郁大鼠对外界的探索行为和好奇心下降等症状[11]。FST通过评估大鼠在游泳中出现的静止不动、游动或攀爬三种状态,反映大鼠的悲观绝望样行为特征[12]。但也有一些学者认为,强迫游泳试验中动物的静止状态可能只是一种适应或疲劳现象,而不是真正的绝望行为[16]。因此,本实验采用体重变化、SPT、OFT和FST等四个指标来综合评估PSD大鼠模型的建立及氟西汀的干预作用。
本实验发现,PSD模型大鼠在CMUS应激后第7、14天时体重下降幅度较卒中组大鼠无统计学差异,但在第21、28和35天时体重的增加较卒中组大鼠明显减慢,提示随着应激事件的累积,PSD模型大鼠的体重增长受到了负面影响,该结果与既往研究报道一致。而与卒中组大鼠比较,PSD模型大鼠的蔗糖水消耗比例(第14、21、28、35天)、OFT中的水平运动得分和垂直运动得分(第28和35天)均显著下降,而且在CMUS后第35天进行的FST显示PSD模型大鼠的不动时间显著延长、游动及攀爬时间显著缩短。以上结果显示,CMUS刺激累积一段时间后,PSD模型大鼠表现出来的抑郁样行为特征越来越显著,也表明PSD大鼠模型建立成功。此外,与PSD组大鼠比较,氟西汀干预后的PSD模型大鼠的体重、蔗糖水消耗比例、水平运动和垂直运动得分、游泳中的不动时间均有明显改善,说明氟西汀能改善PSD模型大鼠的抑郁症状。
MCM2蛋白是一种基因复制相关蛋白,存在于细胞核,是检测海马神经元新生的常用标记物[17]。本实验结果显示,经历MCAO术的大鼠海马齿状回MCM2阳性细胞数明显增加,可能是急性卒中应激诱发了海马神经元新生和重塑;但CMUS联合孤养应激后,大鼠海马齿状回的MCM2阳性细胞数增幅明显下降,并且氟西汀的干预可以部分逆转这种下降趋势。既往研究报道,5-羟色胺1A受体(5-hydroxytryptamine1Areceptor,5-HT1A)能介导5-HT对海马齿状回的神经重塑起促进作用,5-HT缺乏可引起海马齿状回神经发生速度下降,进而促发抑郁[18-19];PSD患者大脑皮层中5-HT和去甲肾上腺素能(norepinephrine,NE)递质水平降低、边缘系统和中缝核5-HT代谢速度显著减慢、脑脊液中5-HT的代谢产物明显下降[20-22],PSD模型大鼠的额叶和海马区5-HT和NE含量也明显降低[23-24],并且使用5-HT和NE再摄取抑制剂对PSD治疗有积极作用[21,24];也有学者认为,脑卒中相关的炎性细胞因子(如IL-1β、IL-6、TNF-α等)增多导致脑内5-HT的耗竭,从而导致PSD发生[25]。因此,5-HT及其相关代谢通路在PSD的发病过程中起重要作用。氟西汀是一种选择性5-HT再摄取抑制剂,临床上常作为抗抑郁治疗的一线用药。本实验结果显示,氟西汀可以显著改善PSD模型大鼠的抑郁样行为,并且促进海马齿状回的神经元再生,这与另一种选择性5-HT再摄取抑制剂(艾司西酞普兰)类似[26],但后者的抗抑郁作用起效更快,可能是因为对海马区神经再生的影响更快[27]。综上所述,海马齿状回的神经再生障碍可能是PSD发病的重要机制之一,同时也可能是氟西汀等抗抑郁药物作用的远隔效应,但其具体机制仍有待从显微形态学、神经营养、信号传导等方面深入研究。
濠㈠湱澧楀Σ锟�:闁冲墎濮甸弸鍐偖椤旇姤闄嶉柤濂変簽閻擄紕绱旈幋娆屽亾娴g儤妯婇柡鍜佸枔閳ь兛妞掔粩楣冨棘閸︻厾鎼兼俊顐熷亾缂佷究鍨洪弳鐔煎箲椤旇偐姘ㄩ柨娑樼焷椤曗晠寮版惔銏℃嫳闁哄倸娲ㄧ亸鐐差啅閼碱剛鐥呴柛娆愬灱閵嗗啰鎲存担绋跨亖闁挎稑鏈导鍐窗濠娾偓缂嶆棃鎳撻敓锟�.闁冲灈鈧剚娲ら柡瀣矋閸嬪秹寮伴娆戠▕闁兼澘鎳嶇粭鏍ㄧ▔瀹ュ棗鍘掗柡鍫墮闁解晠宕i弶璺ㄦ綌缂佲偓閻戞ɑ鐎柣姘煎枙娣囧﹪骞侀敓锟�,闁告瑯鍨垫禒鍫㈠寲閿燂拷閻庢冻闄勫﹢铏亜妤e啯锛�濞存粌鐗呮禍鎺楀礆閻樼粯鐝�.

SCISSCIAHCI