0
留言稍后联系!

发布时间:2019-12-28所属分类:医学论文浏览:1391次
摘 要: 摘要 流行性感冒病毒简称流感病毒, 可以引起禽、猪(Sus)等多种动物以及人的感染和发病, 是重要的人畜共患病病原. 近年来, 多种新型禽流感病毒的出现及其在世界范围内的流行, 导致人感染禽流感病例增加, 加剧了禽流感病毒的公共卫生学危害. 流感病毒感染宿主

摘要 流行性感冒病毒简称流感病毒, 可以引起禽、猪(Sus)等多种动物以及人的感染和发病, 是重要的人畜共患病病原. 近年来, 多种新型禽流感病毒的出现及其在世界范围内的流行, 导致人感染禽流感病例增加, 加剧了禽流感病毒的公共卫生学危害. 流感病毒感染宿主后, 除主要引起呼吸系统疾病外, 也可以导致中枢神经系统等相关病症, 与疾病的预后密切相关. 本文综述了人流感病毒和禽流感病毒神经嗜性的相关研究进展, 从流感病毒相关性脑病的临床特点、流感病毒入侵中枢神经系统的途径, 以及发生神经嗜性的分子机制等几个方面来阐述流感病毒引发神经嗜性的过程与机制, 以期加深对人和禽流感病毒神经嗜性的认识和理解.
关键词 流感病毒, 神经嗜性, 人, 禽
流行性感冒病毒(influenza virus)简称流感病毒, 属于正黏病毒科(Orthomyxoviridae), 是一种有囊膜、分节段的单股负链RNA病毒. 根据核蛋白(nuclear protein, NP)及基质蛋白(matrix protein, M)抗原性的差异, 可将流感病毒分为A, B, C和D四大类型. A型流感病毒可在禽类、哺乳动物及其他多种恒温动物中广泛流行, 宿主种类最多; B型流感病毒仅在人类中流行; C型流感病毒主要在人及猪群中流行; 而新发现的D型流感病毒主要感染猪和牛[1,2]. 其中A型流感病毒亚型众多, 根据血凝素和神经氨酸酶的不同, 可以将其分为 H1~H18和N1~N11, 其中H17N10及H18N11分别于 2009和2010年在食果蝙蝠体内发现[3,4]. 该型病毒的抗原性容易发生变异, 曾多次引起世界性大流行. 目前, 在人类历史上可以追踪到至少5次流感病毒大流行, 分别是1918年西班牙流感大流行、1957年H2N2亚洲流感大流行、1968年H3N2香港流感大流行、1977年 H1N1俄罗斯流感和2009年H1N1流感大流行[5]. 此外, 流感病毒每年不断进化, 产生新的抗原性毒株, 造成持续的流感病毒季节性流行. 2009年pH1N1流感病毒和H3N2亚型流感病毒是当前主要流行的季节性流感病毒亚型(http://www.who.int/en/news-room/fact-sheets/ detail/influenza-(seasonal)). 值得注意的是, 自1997年首次报道禽流感病毒(avian influenza virus, AIV)感染人事件以来, 该病毒不断突破种间屏障感染人类. 截至 2018年11月1日, 人感染H5N1亚型AIV病例确诊860例, 其中454人死亡, 死亡率为53%; H7N9流感病毒自2013年爆发后, 截至2018年11月7日, 已引起1567人感染, 其中615人死亡, 患者死亡率超过39%(http://www.who. int/influenza/human_animal_interface). H9N2亚型AIV 也可以感染人, 血清学证据表明在被调查的人群中感染率可以达到33.5%[6]. 因此, A型流感病毒, 特别是 H1N1, H3N2亚型人流感病毒和H5, H7以及H9亚型 AIV对人类健康产生较大威胁.
神经嗜性是指病毒入侵中枢神经系统后, 在神经系统中有效复制, 并引起神经系统相关疾病的能力[7]. 流感病毒感染宿主后, 主要引起呼吸系统疾病, 有时也会导致呼吸系统外的疾病, 如中枢神经系统相关病症[8,9], 导致病情加重, 预后不良. H1N1和H3N2亚型人流感病毒可引起婴幼儿和孕妇的脑病, 增加了患者的死亡率[10,11]. 近些年, 对H5N1, H7N9以及H9N2等亚型 AIV感染人的病例进行临床特征调查发现, 感染病例也会出现神经系统并发症, 常见脑炎、惊厥、瑞氏综合征[12~14]. 本文在对人流感病毒神经嗜性研究进行综述的基础上, 进一步增加了禽流感病毒的神经嗜性相关研究进展, 综合阐述了不同流感病毒的神经嗜性相关脑病的发病特点、发生发展的分子机制, 以期为流感病毒相关脑病的防治提供参考资料.
1 A型流感病毒的神经嗜性及其引起的脑病
1.1 人流感病毒的神经嗜性及其引起的脑病
人流感病毒感染引起人的急性脑病, 又称流感相关性脑病(influenza associated encephalitis/encephalopathy, IAE), 是指在急性流感病毒感染过程中伴随中枢神经系统(central nervous system, CNS)功能障碍的一种临床综合征, 其导致的病情轻重不一, 典型的临床症状为急性高热后突发惊厥, 患者会快速进入昏迷期甚至死亡. 其中近1/4的病例发生对称性双侧丘脑坏死, 称之为急性坏死性脑病(acute necrotizing encephalopathy, ANE)[15,16]. 早在1918年西班牙流感大流行时期, 就发现嗜睡性脑炎与流感相关. 1957年亚洲流感大流行后正式报道了IAE[17]. 患者初发症状为高热, 之后在极短的时间内出现痉挛、意识障碍等神经系统综合征, 预后极其不良. 流感病毒感染机体后, 会导致不同程度的神经病理损伤或者严重的脑炎. 流感病毒引起的脑炎在孕妇和婴幼儿中最为常见, 严重时甚至导致死亡. 1996~2000年, 流感病毒引起的大脑炎在日本广泛流行, 每年有100~500个感染流感病毒的患者表现出大脑炎的症状[18]. 大部分患者年龄在5岁以下, 主要临床症状表现为癫痫、意识丧失和昏迷等, 死亡率约为 30%[19].
除了日本, 流感病毒在其他国家和地区流行过程中也会引起大脑炎和CNS综合征. 2009年pH1N1流感病毒爆发期间, 有很多CNS功能紊乱的病例报道, 引起了公众的关注[20~23]. 患者常表现出轻微的意识丧失、精神错乱或出现幻觉等临床症状. 患病前, 他们大多性格良好且自制力强. 但患病后, CNS综合征导致患者的自杀率明显提高. 这些患者都服用了奥司他韦进行治疗, 这一药物的使用也有可能致使精神错乱[24]. 病原学调查研究发现, 流感病毒曾在有中枢神经系统损伤症状患者的脑脊液及大脑中被检测到, 其中包括H1N1和H3N2亚型流感病毒[11,25,26]. 除此之外, 流感病毒入侵神经系统后会导致帕金森综合征和癫痫等严重的后遗症[27,28].
流感病毒引起的发热也会导致弥漫性脑水肿, 即急性脑病. 这类疾病在婴幼儿中较常发生, 典型的临床症状表现为急性高热后突发惊厥、意识丧失、癫痫及颅内压增高等[29]. 急性脑病会导致患者长时间的意识丧失, 患者的昏迷指数小于等于13, 持续时间长于 24 h.
急性脑病的发生主要与流感病毒介导的过量细胞因子的表达有关[29]. 当机体为流感病毒易感体质时(如编码细胞核膜蛋白、RAN结合蛋白2、线粒体酶和肉碱棕榈酮转移酶的基因发生突变), 流感病毒感染机体后则更容易引起急性坏死性脑病[30~32]. 大量促炎因子的分泌(TNF-α和IL-6)会导致大脑和其他组织血管内皮损伤及实质细胞调亡, 进而破坏血脑屏障, 引起脑水肿和全身多器官损伤[27]. 血-脑屏障的破坏会导致炎性细胞、病毒和大量蛋白质进入脑脊液; 非甾体抗炎药 (双氯芬酸钠和甲灭酸)的使用也会增加脑病患者的死亡率[29]. 除了上述较常见的脑病之外, 流感病毒感染机体还会引起其他脑病综合征, 包括急性脑病伴随双侧癫痫和迟发性扩散(acute encephalopathy with biphasic seizures and late reduced diffusion, AESD)以及临床轻微脑病伴随可逆的夹肌损伤(clinically mild encephalitis/encephalopathy with a reversible splenial lesion, MERS)等, 同样值得关注[33,34].
1.2 禽流感病毒的神经嗜性及其引起的脑病
禽类在感染高致病性H5N1亚型AIV后, 会表现出明显的神经症状[35,36]. 研究发现, 高致病性H5N1亚型 AIV感染鸡后, 对血管内皮细胞有很强的亲和力, 可由血液传送至不同组织的实质细胞, 包括大脑的神经细胞[37]. 鸡和鸭感染高致病性H5N1亚型AIV后会表现出中枢神经系统紊乱、全身抖动、身体失去平衡和头颈震颤等临床症状[38,39], 鸽子感染高致病性H5N1亚型 AIV后会出现头颈歪斜、眼球震颤和羽翼麻痹等症状[40]. 尽管目前还没有禽类感染H7N9流感病毒出现神经症状的相关报道, 但是有研究表明, 从感染H7N9的禽的大脑中可以检测到较高滴度的流感病毒[41], 但是其有无神经症状的出现, 仍需进一步调查.
近年来, 随着禽流感病毒不断地发生基因重排, 病毒已经跨越了种间障碍, 获得了感染哺乳动物的能力. H9N2, H5Nx和H7N9亚型AIV感染人的病例相继被报道[14,42~44]. 除了这几种亚型AIV外, H10N7亚型AIV也可以在哺乳动物体内不断适应之后, 呈现广泛的组织嗜性, 甚至突破血脑屏障感染哺乳动物神经系统[45]. 对人感染H5N1亚型高致病性禽流感的临床特征分析显示, 在236例人感染禽流感病例中, 74例表现易激惹 (31.36%), 59例表现意识障碍(25%)的神经症状[12]. 病原学数据证明, 在1997年香港发生人感染禽流感期间, 从第三个人感染病例中成功分离到了H5N1亚型AIV, 该分离株具有对小鼠(Mus musculus)的神经毒性[46]. 此外, Pringproa等人[47]利用体外感染实验研究显示, 人的神经元细胞对H5N1亚型高致病性禽流感病毒非常敏感, 并且病毒感染后可显著上调TNF-α的水平, 影响神经细胞的增殖和分化. 可见, 禽流感病毒脑病既是病毒对中枢神经系统的直接侵袭, 同时也是细胞因子介导的反应. 此外, 对感染禽源H7N9病毒的6个病例的临床分析显示, 其中2例呈现神经系统并发症[13]. 体外研究表明, 与2009年pH1N1病毒相比, H7N9亚型流感病毒更易感染星形胶质细胞和神经元, 并能在其中有效转录和复制[44].
尽管禽流感病毒感染人导致的高死亡率引起了广泛关注, 但是该病毒引起的神经症状却常常被忽视. 这种高死亡率可能与禽流感病毒的神经嗜性密切相关. 因此, 我们应该对禽流感病毒的神经嗜性给予高度重视, 并深入探讨禽流感病毒和人流感病毒神经嗜性的获得以及对神经中枢致病机制的异同, 以探究不同的防治措施.
2 流感病毒入侵中枢神经系统的途径
与其他嗜神经性病毒一样, 具有神经嗜性的流感病毒也可通过多种途径入侵机体的中枢神经系统. 对流感病毒入侵中枢神经系统途径的研究将有助于理解病毒的神经嗜性机制以及开发特效的阻断剂阻止流感病毒对机体中枢神经系统的感染. 中枢神经系统是由血脑屏障保护的机体特异性器官, 因此, 病毒需要穿越血脑屏障入侵中枢神经系统. 目前认为, 流感病毒可通过细胞和细胞间隙两种方式穿越血脑屏障, 前者为直接感染血脑屏障组成细胞和跨细胞途径, 后者为破坏内皮细胞间紧密连接及“特洛伊木马”途径. 除了穿越血脑屏障外, 流感病毒还可以通过神经途径直接入侵机体的中枢神经系统(图1).
2.1 流感病毒穿越血脑屏障的两种途径
血脑屏障位于血管和脑组织之间, 可以选择性地阻止一些物质由血液进入大脑, 是血-脑、血-脑脊液和脑脊液-脑三种屏障的总称. 电子显微镜下观察血脑屏障的超微结构发现: 血脑屏障主要由脑微血管内皮细胞(brain microvascular endothelial cell, BMEC)及其细胞间的紧密连接、基膜、小胶质细胞、周细胞及星形胶质细胞围成的神经胶质膜构成[48,49]. 其中BMEC 是血脑屏障的主要结构, 它通过顶端面与血流接触, 通过基底面与脑内相通, BMEC之间的紧密连接可有效抑制细胞旁路途径的物质转运[50]. 除此之外, 小胶质细胞会在病原体刺激下释放细胞因子, 来清除病原体; 周细胞可调控血管的形成及血管的完整性; 星形胶质细胞通过分泌可溶性因子来促进紧密连接及血脑屏障的完整性[50]. 这些结构均可有效抑制病毒入侵中枢神经系统.
血脑屏障可维持中枢神经系统稳态, 限制血液中大多数病原体的入侵; 然而部分病毒可穿越血脑屏障侵入中枢神经系统, 导致中枢神经功能紊乱及炎性反应. 流感病毒穿越血脑屏障后通过表面蛋白与脑细胞表面蛋白相互作用, 介导了炎性因子的表达并促进病毒在神经元中的有效复制, 最终导致神经元变性坏死, 引起惊厥、意识障碍等脑炎症状. 流感病毒主要通过细胞途径和细胞间隙途径穿越血脑屏障.
(1) 细胞途径. BMEC是血脑屏障的主要结构, 对 BMEC的有效感染是病毒入侵中枢神经系统必经之路之一[51]; 人多瘤病毒JC[52]和人嗜T细胞病毒1型[53]均可感染人脑微血管内皮细胞(human brain microvascular endothelial cell, HBMEC), 并在HBMEC内复制并释放子代病毒, 造成神经元变性与坏死, 然而流感病毒是否也会通过感染HBMEC入侵宿主的中枢神经系统尚未见报道. 但是, 多项研究表明流感病毒可以感染小胶质细胞、周细胞及星形胶质细胞, 这些细胞也是血脑屏障的组成部分[44,47]. 因此, 流感病毒可以通过感染这些细胞穿越血脑屏障.
此外, 正常情况下血脑屏障是非渗透性的, 但存在多种特殊的跨细胞转运作用, 如内吞与胞吞作用[50]. Verma等人[54]应用体外血脑屏障模型, 发现西尼罗病毒可利用BMEC的巨胞饮作用, 在不破坏血脑屏障完整性的前提下可穿越血脑屏障. BMEC的巨胞饮作用作为该细胞的活动特性, 或许一定程度上也为流感病毒穿越血脑屏障、入侵中枢神经系统提供了有效的途径.
(2) 细胞间隙途径. BMEC间的紧密连接是维持血脑屏障结构与功能完整性的基础, 可调控物质运输并限制病原体通过细胞旁路途径进入中枢神经系统. 紧密连接由连接黏附分子、封闭蛋白及闭合蛋白等多种跨膜蛋白组成, 通过紧密连接分子等固定附着在内皮细胞上[49]. 流感病毒的感染会破坏紧密连接, 导致紧密连接的通透性増加, 使病毒可穿越血脑屏障入侵并感染中枢神经系统.
血脑屏障处细胞因子的表达与其效应之间的平衡是错综复杂的. 通常情况下, 流感病毒特别是H5N1和 H7N9亚型AIV感染星形胶质细胞可刺激促炎因子的释放, 如IL-1β, IL-6, IFN-λ和TNFα[44,47]. 大量炎性因子的产生会导致紧密连接间的通透性增加, 一定程度上破坏了血脑屏障的完整性, 促进流感病毒对中枢神经系统的入侵和感染. BMEC、周细胞、星形胶质细胞及白细胞等均可产生上述细胞因子. 不同细胞因子的作用机制各不相同, 对血脑屏障的影响也不同. 西尼罗病毒感染星形胶质细胞时可产生基质金属蛋白酶 (matrix metalloproteinase, MMP), MMP会通过直接降解紧密连接, 来破坏血脑屏障, 加速病毒对中枢神经系统的感染[55]; 而IFN-β则可稳定紧密连接, 并激活 BMEC中的TAM(Tyro3, Ax1和Mertk)受体来协同干扰素的作用, 增强紧密连接的稳定性, 从而维持血脑屏障的完整性[55].
此外, 病毒还可通过“特洛伊木马”途径入侵中枢神经系统, 即感染白细胞后, 由白细胞携带穿越血脑屏障. 免疫缺陷病毒(包括猴免疫缺陷病毒和人类免疫缺陷病毒就可利用这一途径, 由被感染的单核细胞或巨噬细胞携带穿越血脑屏障[55]. 有研究表明, H5N1亚型AIV可以利用树突状细胞作为“运载工具”感染多个脏器, 包括脑, 其有可能就是利用“特洛伊木马”途径入侵中枢神经系统[56].
2.2 神经途径
除了通过细胞途径和细胞间隙途径穿越血脑屏障入侵中枢神经系统外, 流感病毒还可通过神经通路直接入侵哺乳动物的中枢神经系统. 在小鼠体内的研究结果表明, 流感病毒既可通过鼻腔的嗅神经和三叉神经入侵小鼠的中枢神经系统[44,57,58], 也可通过肺部的迷走神经和交感神经入侵小鼠的中枢神经系统[46]. 在雪貂中, 高致病性H5N1亚型AIV能够感染嗅神经的鼻黏膜受体神经元(olfactory receptor neurons, ORNs), ORNs上有一个通过筛状板延伸到嗅球突触球层的轴突, 从这里传播到嗅球, 感染嗅球中的轴突突触和神经细胞, 进而传播到中枢神经系统[59]. 目前已有研究表明高致病性禽流感病毒能在轴突间进行传播[60,61], 对 ORNs的感染为H5N1亚型AIV入侵中枢神经系统提供了更直接的路径[62]. 在人体内, 流感病毒也可利用神经通路作为捷径入侵机体中枢神经系统. 临床上, 曾在一个免疫功能不全的儿童体内发现季节性H3N2亚型流感病毒可通过嗅神经通路入侵中枢神经系统[63]. Simon等人[64]报道过一个病例, 发现健康男子在感染流感病毒后, 并未出现任何呼吸系统疾病相关症状, 但表现出致死性脑炎的症状, 对病毒的检测结果发现, 可以在病人的鼻洗液和脑组织中检测到病毒, 而在肺部和脑脊液中均未检测到病毒的存在. 除此之外, 临床上还有两例有高致病性H5N1亚型AIV传播到中枢神经系统但是并没有引起严重呼吸道疾病的病例报告(2 个儿童有严重的脑膜炎但是没有呼吸系统疾病), 证明流感病毒可通过神经通路传导到中枢神经系统[65].
由此可见, 流感病毒可以通过多种途径入侵宿主的中枢神经系统. 然而, 人流感病毒和禽流感病毒是否依赖相同的感染途径尚未可知, 目前研究表明禽流感病毒偏向利用神经途径入侵宿主的中枢神经系统, 其具体的原因有待探究. 但是, 近些年禽流感病毒组织嗜性的增强更易造成宿主出现病毒血症, 这或许增加了禽流感病毒对宿主中枢神经系统的威胁. 因此, 应对极易造成病毒血症的禽流感病毒给予重视.
3 影响流感病毒神经嗜性的关键因素
3.1 病毒关键基因片段及毒力位点
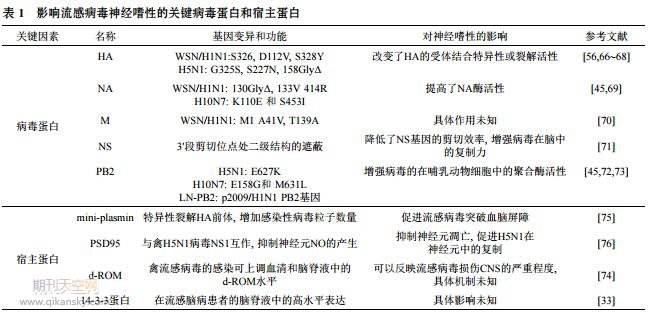
小鼠常被作为哺乳动物模型, 研究流感病毒对神经系统的入侵途径及影响神经嗜性的分子机制等. 与流感病毒感染呼吸系统的分子机制研究相比, 流感病毒神经嗜性机制研究相对薄弱. 但根据有限的报道, 可以发现流感病毒的血凝素基因(HA)、神经氨酸酶基因(NA)、基质蛋白基因(M)以及非结构蛋白(NS)片段在其神经嗜性中发挥着重要的作用. 除了这几个片段外, 聚合酶PB2基因及其编码蛋白对禽流感病毒的神经嗜性可能起到关键作用(表1).
(1) HA的作用. 流感病毒的HA基因, 编码病毒的表面蛋白血凝素. HA蛋白介导流感病毒对宿主细胞唾液酸受体的吸附, 是流感病毒感染宿主细胞的第一步. 在病毒复制过程中, HA的mRNA被翻译成HA0, HA0 被水解为HA1和HA2的过程中会引起位于HA2-N末端的“融合肽(fusion peptide)”的产生. 正常情况下, 融合肽呈环状[77], 当HA处于酸性条件下时, 其环状结构转化成螺旋结构, 导致融合蛋白上升并插入胞内体膜中, 完成膜融合过程[78]. HA蛋白的裂解活性决定着流感病毒的感染性[79]. Nakajima等人[80]在体外神经元中最早证明了HA的裂解对流感病毒神经嗜性的获得具有重要作用, 研究发现流感病毒的HA在不同的细胞类型中具有不同的裂解活性, HA的高裂解活性使得病毒能够在部分神经细胞中有效复制, 有利于子代病毒粒子的组装. Zhang等人[66]报道了H5N1 HA裂解位点处325位 (P6位)丝氨酸增强了病毒HA的裂解活性, 使得流感病毒获得了对小鼠的神经毒性. HA多碱性氨基酸裂解位点的存在也贡献了流感病毒对雪貂的神经嗜性[67]. 在 WSN/H1N1病毒中, 当把HA裂解位点P2位的酪氨酸 (328Y)替换为H1亚型上常见的丝氨酸后, 病毒在小鼠脑中的复制能力显著降低, 说明328Y对WSN/H1N1病毒的神经嗜性至关重要[68]. 值得注意的是, 当人为地在季节性H3N2病毒中引入多碱性氨基酸裂解位点, 病毒仍旧无法获得在哺乳动物体内的神经嗜性, 证明多碱性氨基酸裂解位点对于流感病毒的神经嗜性是必要不充分条件[67]. 其次, HA受体结合位点也对流感病毒的神经嗜性十分重要. Yen等人[56]发现A/Vietnam/ 1203/04(H5N1)引入HA-S227N和158位去糖基化后, 病毒在脑中的复制滴度明显下降, 感染病毒的小鼠的神经症状消失, 表明了受体结合区域在这一过程中的重要作用.
(2) NA的作用. 神经氨酸酶基因(NA)编码病毒的另一个表面蛋白, 具有酶活性糖基化的神经氨酸酶, 能催化唾液酸末端残基和邻近糖链上的残基之间酮苷键的裂解, 促进子代病毒粒子的出芽[81]. 神经氨酸酶被认为是决定WSN/H1N1病毒神经嗜性的另一关键基因片段, NA-C末端具有结合纤溶蛋白酶原的能力, 146 位糖基化位点的缺失可增加NA结合纤溶蛋白酶原的能力, 并将纤溶蛋白酶原转化成纤溶蛋白酶, 促进HA 的裂解, 从而使病毒对小鼠具有神经毒性[69]. 具有神经嗜性的H10N7鼠适应性毒株的NA基因也出现两个关键的氨基酸变异, K110E和S453I. 其中K110E的突变显著增强了病毒的神经氨酸酶活性, 虽然单独的 K110E突变并不能引起病毒对哺乳动物的神经嗜性, 但当其与PB2上的位点协同突变时, 可以导致病毒对小鼠中枢神经系统的感染[45]. 此外, Maurizi[82]认为 1918年流感大流行引起的高死亡率主要是由于病毒对人的神经毒性, 其中病毒神经氨酸酶的种类对流感病毒的神经毒性起关键作用, 然而该研究并没有给出具体的实验证据. 神经氨酸酶对流感病毒神经嗜性的获得究竟如何作用, 仍需要进一步探究.
(3) M和NS的作用. 流感病毒的M和NS基因均可编码两种病毒蛋白, 分别为M1, M2, NS1和NS2. M1蛋白的解离促进了病毒vRNP的入核; M1蛋白决定了流感病毒的复制速率[83]. NS1和NS2蛋白作为流感病毒的两个非结构蛋白, 在流感病毒抵御宿主先天免疫过程中发挥重要作用[84], 此外, NS2蛋白也能够与M1蛋白直接互作, 参与子代病毒粒子的组装过程[85]. M和 NS基因似乎也一定程度上决定了流感病毒的神经嗜性. 有研究报道, M141位的缬氨酸和139位的丙氨酸对 WSN/H1N1病毒神经嗜性的获得起决定作用, 但是其具体作用机制仍不清楚[70]. 此外, 流感病毒复制过程中, 非结构蛋白NS1和NS2的相对含量也影响着病毒的复制和转录水平, 甚至也决定了病毒的神经嗜性. 研究表明, 不具有神经嗜性的A/WS/33(H1N1)病毒的 NS1的表达低于NS2的表达水平; 相反, 具有神经嗜性的WSN/H1N1病毒NS1的表达量显著高于NS2[71], 暗示NS1蛋白的高表达或许在流感病毒神经嗜性的获得中起到重要作用.
(4) 其他基因的作用. 除此之外, 许多研究表明, 流感病毒的其他内部基因也对其神经嗜性的获得具有重要作用. 尤其是禽流感病毒PB2 E627K变异可通过提高病毒在哺乳动物细胞中的聚合酶活性, 影响H5N1 禽流感病毒对哺乳动物的神经毒性[72]. 并且, Lin等人[73]报道称引入2009 pH1N1 PB2基因的H5N1亚型 AIV获得了对小鼠的神经毒性, 可见, 流感病毒基因片段之间的不断重排也是流感病毒获得神经嗜性的重要原因. 此外, Zhang等人[45]报道了H10N7鼠适应性毒株的PB2 E158G和M631L也可影响H10N7亚型禽流感病毒的神经嗜性.
由此可见, 流感病毒HA, NA, PB2, M和NS基因对其神经嗜性均有重要贡献. 在这些基因中, 它们对人流感病毒和禽流感病毒的贡献各不相同. 多项研究表明, 与其他片段相比, 聚合酶基因在禽流感病毒神经嗜性的获得中似乎起着更重要的作用. 可见, 更多的神经嗜性机制研究将有利于更全面认识流感病毒各基因对流感病毒神经嗜性的影响.
相关论文推荐:A型流感病毒及其M1蛋白概述
摘要:A型流感病毒是一种流行广泛且死亡率很高的病毒,对人类及动物都造成了极大的影响。M1蛋白作为维持A型流感病毒基本形态的蛋白,在其生命周期中起着重要作用,但其具体结构和功能仍有待探讨。对A型流感病毒的基本分子生物学特性进行了综述,并对其基质蛋白M1的生物学特性、功能和结构做了阐述。
声明:①文献来自知网、维普、万方等检索数据库,说明本文献已经发表见刊,恭喜作者.②如果您是作者且不想本平台展示文献信息,可联系学术顾问予以删除.

SCISSCIAHCI