0
发表咨询在线!

发布时间:2020-02-22所属分类:医学论文浏览:1462次
摘 要: 摘要背景:现有方法将外源分子如DNA导入到人胚胎干细胞用于科学研究的效率普遍较低,如何优化现有条件,提高转染效率显得尤为重要。目的:比较两种不同的传代方法对人胚胎干细胞系H9转染效率的影响,优化胚胎干细胞转染条件。方法:人胚胎干细胞系H9分别采用

摘要背景:现有方法将外源分子如DNA导入到人胚胎干细胞用于科学研究的效率普遍较低,如何优化现有条件,提高转染效率显得尤为重要。目的:比较两种不同的传代方法对人胚胎干细胞系H9转染效率的影响,优化胚胎干细胞转染条件。方法:人胚胎干细胞系H9分别采用小克隆传代法和单细胞传代法进行传代,传代后继续培养细胞48h,用Lipofectamine3000转染pAdTrack-AKT1荧光质粒2d后,荧光显微镜下观察荧光质粒的表达,流式细胞仪检测人胚胎干细胞的转染效率;RT-qPCR和Westernblot分别检测转染后AKT1在mRNA和蛋白质水平的表达。结果与结论:①荧光显微镜下观察发现单细胞传代组表达荧光质粒的细胞数量更多,流式细胞仪检测单细胞传代法的转染效率[(47.18±2.00)%]高于小克隆传代法的转染效率[(19.52±0.86)%],差异有显著性意义(P<0.01);②单细胞传代组转染后AKT1mRNA和蛋白的表达均高于小克隆传代组,差异有显著性意义(P<0.01);③结果表明,采用单细胞传代法,增加细胞与转染试剂脂质体的接触面积可提高人胚胎干细胞的转染效率。
关键词:人胚胎干细胞;小克隆传代法;单细胞传代法;脂质体转染;转染效率
0引言Introduction
胚胎干细胞是一类起源于胚胎发育早期囊胚内细胞群中未分化的细胞,具有自我更新、无限增殖和多向分化的潜能[1],故其在医学上具有非常重要的研究价值与应用前景[2-5]。基因转染是研究胚胎干细胞生理功能和分化发育机制的重要技术手段[6],但其转染效率受诸多因素的影响,如细胞状态、质粒DNA的大小、转染方法及其操作细节等[7]。目前常用的转染方法有慢病毒转染、核电转、脂质体转染等[8],其中脂质体转染无免疫和突变风险[9],是稳定转染人胚胎干细胞(humanembryonicstemcells,hESCs)的理想试剂。该研究基于脂质体转染法发现人胚胎干细胞使用单细胞传代法传代的细胞转染效率明显优于小克隆传代法。该法简单稳定有效,将为人胚胎干细胞的转染提供有力的技术支撑,为人胚胎干细胞的临床应用研究增添新的方法和策略。
1材料和方法Materialsandmethods
1.1设计细胞学实验观察。
1.2时间及地点实验于2018年7月至2019年4月在徐州医科大学脑病生物信息重点实验室完成。
1.3材料
1.3.1实验材料人胚胎干细胞系H9、pAdTrack-AKT1荧光质粒由作者所在实验室保存。
1.3.2实验试剂mTeSR1培养基、消化酶Accutase、Y-27632(STEMCELL公司);基质胶Matrigel(CorningBioCoat公司);转染试剂Lipofectamine3000、Opti-MEM1减血清培养基、免疫荧光二抗(Invitrogen公司);反转录试剂及定量PCR试剂(Takara公司);SOX2、OCT4、AKT1抗体(CellSignalingTechnology公司);定量PCR引物(上海生工合成)。
1.3.3实验仪器荧光显微镜(Olympus,日本);流式细胞仪(BD,美国);激光共聚焦荧光显微镜(Zeiss,德国);PCR扩增仪2720ThermalCycler(AppliedBiosystems,美国);稳压/稳流DNA电泳仪(Bio-Rad,美国);细胞培养箱(Thermo,美国);超净工作台(苏州安泰空气技术有限公司,中国)等。
1.4实验方法
1.4.1人胚胎干细胞的复苏、培养及鉴定采用无饲养层培养条件,细胞培养皿表面均经Matrigel包被过夜。取出冻存于液氮中的人胚胎干细胞系H9,在37℃水浴中快速震荡溶解至有少许冰残留;吸取冻存液,逐滴加入人胚胎干细胞培养基mTeSR1,轻摇混匀,1000r/min离心5min后弃上清,用mTeSR1重悬混匀,接种于包被好Matrigel的细胞培养皿表面,每天换液。细胞使用Accutase初步消化后,用枪头机械刮取细胞碎片,以1∶4的比例传代,约7d传代1次。
1.4.2人胚胎干细胞的传代吸弃培养基,加入复温的Accutase消化酶,显微镜下观察克隆边缘的细胞皱缩,克隆内部有裂痕,吸弃Accutase,进行下一步处理:①小克隆传代法:立即终止消化,加入mTeSR1,用枪头轻轻吹打使细胞形成细小碎片,接种至6孔板;②单细胞传代法:将培养皿放入37℃恒温箱,等待约1min后取出,细胞呈单个状态,加入含10μmol/LY-27632的mTeSR1轻轻吹打混匀,接种至6孔板,放置于37℃,体积分数为5%CO2培养箱培养。
1.4.3人胚胎干细胞的转染及转染效率检测当细胞汇合度达到30%-60%(传代48h后)时进行转染。取2个无菌1.5mLEppendorf管,分别加入125μLOpti-MEM1减血清培养基,其中一管加入适量Lipofectamine3000轻柔混匀;另一管加入pAdTrack-AKT1荧光质粒(10660bp),涡旋混匀后逐滴加入含Lipofectamine3000的混合液中,室温孵育10-15min,形成脂质体复合物。将脂质体复合物逐滴加入培养基,轻轻摇动细胞培养板,使复合物分散均匀。在37℃,体积分数为5%CO2培养箱内培养48h,流式细胞仪检测转染效率。
1.4.4细胞免疫荧光检测SOX2、OCT4的表达人胚胎干细胞用37℃的PBS洗5遍,40g/L多聚甲醛4℃固定20min,吸弃多聚甲醛,常温PBS洗后封闭。一抗稀释于含3%BSA和0.3%Triton-100的PBS(SOX21∶400稀释,OCT41∶800稀释),4℃避光过夜,次日室温30min复温,常温PBS清洗后孵育二抗(1∶500稀释),避光2h,DAPI染核5min,常温PBS清洗后荧光显微镜观察。
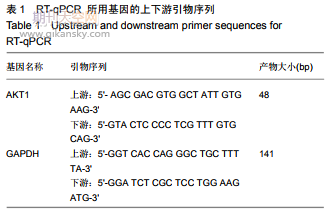
1.4.5实时荧光定量PCR(RT-qPCR)检测AKT1的mRNA表达Trizol法收集转染后人胚胎干细胞,按照试剂盒说明书进行实验,提取总RNA样本、反转录并进行RT-qPCR实验,检测AKT1的mRNA水平。RT-qPCR程序为预变性95℃30s;变性95℃5s,退火60℃30s(40次循环);每个样本均设置3个重复。引物见表1。
1.4.6蛋白质印迹实验(Westernblot)检测AKT1的蛋白表达转染后的人胚胎干细胞加入匀浆液,细胞总蛋白质(20μg)于10%SDS-聚丙烯酰胺凝胶电泳分离,100V电压转膜70min,室温下3%BSA封闭3h,鼠抗人AKT1抗体(1∶2000稀释)4℃孵育过夜后,鼠二抗(1∶10000稀释)室温孵育1h。内参蛋白抗体选用兔抗人GAPDH(1∶2000稀释)。QuantityOne图像分析软件对蛋白条带进行扫描分析,以GAPDH为参照,AKT1表达的相对含量以目的条带与内参条带灰度值的比值表示。
1.5主要观察指标①荧光显微镜观察人胚胎干细胞转染AKT1质粒后的荧光表达;②流式细胞仪检测细胞转染效率;③RT-qPCR检测AKT1的mRNA表达;④Westernblot检测AKT1的蛋白表达。
1.6统计学分析实验数据均以x_±s表示。组间均数比较采用独立样本t检验,P<0.05为差异有显著性意义。统计分析用SPSS16.0软件,图表制作用GraphPadPrism7.0软件。
推荐阅读:怎么发外文的医学论文
2结果Results
2.1人胚胎干细胞正常形态及未分化状态鉴定结果在Matrigal胶上贴壁培养的人胚胎干细胞呈克隆样生长,细胞排列紧密,核质比高,细胞集落边缘光滑,生长状态良好,无边缘细胞向外明显延展和核质比降低等分化表现,随着培养天数增加细胞集落逐渐融合,培养7d时细胞汇合度可达80%-90%,见图1。通过细胞免疫荧光检测,人胚胎干细胞均表达其特异性标志物SOX2和OCT4,见图2。
2.2人胚胎干细胞转染AKT1质粒后的荧光表达不同方式传代的人胚胎干细胞在传代后继续培养48h,光学显微镜下观察细胞状态,可见小克隆传代的细胞之间致密紧凑;单细胞传代的细胞结构清晰,仍趋向克隆样生长,细胞与细胞之间连接较松散,见图3A,D。转染48h后,使用荧光显微镜观察不同传代方式的细胞转染效率,发现在去除ROCK抑制剂Y-27632(可以阻止人胚胎干细胞因分离导致的细胞凋亡,提高单个人胚胎干细胞的存活率)后,单细胞传代的人胚胎干细胞仍呈克隆样紧密生长,见图3E。单细胞传代后转染pAdTrack-AKT1荧光质粒48h的荧光细胞数目明显多于小克隆传代法,见图3C,F。流式细胞仪检测单细胞传代的人胚胎干细胞转染效率为(47.18±2.00)%,小克隆传代的人胚胎干细胞转染效率为(19.52±0.86)%,单细胞传代法的转染效率高于小克隆传代法(P<0.01,n=5),见图4。镜下观察时也未见明显分化的细胞,表明单细胞传代的细胞用脂质体转染是安全稳定且高效的。
2.3人胚胎干细胞转染AKT1质粒后其mRNA和蛋白质水平的表达单细胞传代组AKT1在mRNA和蛋白质的表达水平均显著高于小克隆传代组(P<0.01,n=3),见图5。
3讨论Discussion
人胚胎干细胞是非常难转染的细胞之一,目前常用的转染方法的效率均较低[10-11]。综合比较来看慢病毒转染效率最高,但是病毒转染具有较大的免疫原性、插入诱变和病毒整合进宿主基因的风险[12-13]。核转染需要将人胚胎干细胞消化成单个细胞,转染后细胞存活率低[14],且需购买专用的细胞转染试剂盒和核转仪,费用较高。脂质体转染无免疫和突变风险,转染效果稳定[15-16],但以往的研究认为该法转染效率较低。随着技术改进,脂质体转染人胚胎干细胞的效率正逐步提高,Lipofectamine2000是一种有效的转染试剂且在许多研究中应用,而Lipofectamine3000是其新一代的改进产品,与Lipofectamine2000相比其转染效率更高,细胞毒性更小[17]。影响脂质体转染效率的因素包括脂质体复合物的形成、与细胞表面的相互作用、DNA的释放和传递到细胞核等。在单层贴壁培养条件下,人胚胎干细胞克隆边缘的转染效率高,克隆内部的细胞密集,与转染试剂的作用面积小,加之细胞本身的外排作用[18],导致大克隆细胞转染效率低。人胚胎干细胞常规培养呈克隆样密集生长,单个细胞的存活率较低,而Y-27632可以阻止单个人胚胎干细胞易发生的细胞凋亡,在不影响人胚胎干细胞自我更新和多潜能特性的前提下提高单个人胚胎干细胞的存活率[19],且在转染之前使细胞处于相对良好的状态,有利于脂质体复合物与细胞的相互作用,故转染效率得以提高。人胚胎干细胞使用酶消化单细胞传代法传代数代,仍可维持细胞多能性、未分化和遗传正常状态[20-23]。也有研究表明使用单细胞传代5代后可检测到染色体和核型异常[24],但作者的研究只在转染时使用单细胞传代,在常规培养中并不使用单细胞连续传代,故细胞基因组的稳定性良好。该研究从安全稳定的脂质体转染法入手,转染带绿色荧光标记的AKT1质粒来研究现有条件下如何优化人胚胎干细胞的转染效率,通过流式细胞仪检测转染效率结合RT-qPCR和Westernblot检测转染AKT1质粒后其mRNA和蛋白表达水平,结果表明单细胞传代法降低细胞汇合度和细胞间的紧密程度可明显提高人胚胎干细胞的转染效率;同时也发现细胞密度过小,脂质体毒性作用明显,细胞死亡增多,转染效率亦不高。因此,转染前优化细胞状态对细胞的转染效率也是至关重要的。
婢圭増妲�:閳剁姵鏋冮悮顔芥降閼奉亞鐓$純鎴欌偓浣烘樊閺咁喓鈧椒绔鹃弬鍦搼濡偓缁便垺鏆熼幑顔肩氨閿涘矁顕╅弰搴㈡拱閺傚洨灏炲鑼病閸欐垼銆冪憴浣稿灁閿涘本浼冮崰婊€缍旈懓锟�.閳垛€愁洤閺嬫粍鍋嶉弰顖欑稊閼板懍绗栨稉宥嗗厒閺堫剙閽╅崣鏉跨潔缁€鐑樻瀮閻氼喕淇婇幁锟�,閸欘垵浠堢化锟�鐎涳附婀虫い楣冩6娴滃牅浜掗崚鐘绘珟.

SCISSCIAHCI