0
留言稍后联系!

发布时间:2020-02-22所属分类:医学论文浏览:1291次
摘 要: 摘要背景:研究表明Asxl1的缺失可导致骨质发育不全、骨质缺损类疾病的发生,但目前在根尖周炎环境下该因子与骨破坏之间的关系暂无相关报道。目的:探讨炎性微环境下Asxl1对成骨细胞增殖分化的影响。方法:实验选用脂多糖刺激MC3T3-E1细胞建立体外炎性微环境

摘要背景:研究表明Asxl1的缺失可导致骨质发育不全、骨质缺损类疾病的发生,但目前在根尖周炎环境下该因子与骨破坏之间的关系暂无相关报道。目的:探讨炎性微环境下Asxl1对成骨细胞增殖分化的影响。方法:实验选用脂多糖刺激MC3T3-E1细胞建立体外炎性微环境,通过CCK-8实验筛取脂多糖最佳质量浓度和最佳作用时间,然后用20mg/L脂多糖刺激MC3T3-E1细胞24h,免疫荧光检测Asxl1的蛋白表达水平,RealTime-PCR检测Asxl1mRNA的表达水平。为进一步验证Asxl1基因在炎性微环境中影响成骨细胞的增殖与分化,脂多糖刺激形成炎性微环境后转染Asxl1-SiRNA24h,采用CCK-8检测细胞增殖活性,RealTime-PCR检测Asxl1及成骨相关基因ALP和RUNX2mRNA的表达水平。结果与结论:①脂多糖刺激MC3T3-E1细胞后,Asxl1蛋白和mRNA表达水平呈降低趋势;②脂多糖刺激MC3T3-E1细胞后,转染Asxl1-SiRNA24h,细胞增殖活性下降趋势明显,Asxl1基因及成骨相关基因ALP和RUNX2mRNA的表达水平明显降低;③结果提示,Asxl1可能通过参与炎性反应过程,影响成骨细胞的增殖与分化,进而参与骨破坏进程。
关键词:MC3T3-E1细胞;Asxl1;根尖周炎;骨破坏;基因转染;脂多糖;成骨分化;国家自然科学基金
0引言Introduction
根尖周炎是发生于牙根尖周软硬组织的破坏性疾病,多继发于牙髓病及根尖周围组织其他炎性疾病。当根尖周炎症处于慢性进展期时,其炎症反应过程受机体全身状态的影响。牙髓病长期不治疗或经根管治疗不彻底,根管内存在大量感染性物质或病原微生物,导致根管内炎症递质、细胞因子和相关酶释放,激活大量炎症细胞,从而引发根尖周炎[1-3],其主要临床表现为肉芽组织的形成和牙槽骨骨质的破坏[4-6]。骨质破坏即骨形成的动态偶联过程遭到破坏,此时成骨细胞形成新骨的能力弱于破骨细胞吸收旧骨的能力,骨稳态平衡被打破[7]。已知炎症微环境可通过抑制成骨细胞的增殖与分化,从而破坏正常的骨偶联过程,导致骨质破坏[8]。慢性根尖周炎造成的骨破坏,即当根尖周围组织处于炎性微环境时,宿主通过对炎症微生物及其感染物质作出的免疫反应。针对炎症反应造成的骨稳态失衡机制较复杂,仍然有待进一步研究。
脂多糖是大多数革兰阴性细菌细胞壁的主要脂质成分,其包含3个结构:脂质A、核心寡糖和可变多糖(O抗原)[9-10]。脂多糖可在细菌细胞分裂或死亡过程中释放,形成细胞内毒素,导致单核细胞和吞噬细胞产生大量细胞因子,引起炎症发生[11]。因而,脂多糖常被广泛用于诱导炎症环境发生的分子机制研究[12]。
Asxl1被发现存在于染色体上,编码核蛋白,对基因表达稳定性的维持起主要作用。该基因表达于所有的造血细胞,且在其他多种组织中也存在广泛表达[13-14]。Asxl1基因突变体最早发现于骨髓样恶性肿瘤患者中,如急性髓系白血病、骨髓增生异常综合征等疾病,因此,众多学者主要研究方向为该基因与髓系疾病之间的关系,结果发现Asxl1基因突变体存在于多种髓系肿瘤患者的造血细胞中,往往预后不良[15-17]。但近期有研究学者发现该基因可影响骨髓间充质干细胞成骨分化,同时研究发现Asxl1基因缺失会诱导骨髓间充质干细胞远离成骨分化[18],导致骨偶联失衡即破坏骨稳态,因此Asxl1基因与骨破坏之间也存在一定的关系。为了近一步研究Asxl1与骨破坏之间的关系,以及该基因在根尖周炎环境下与骨破坏的关系,该实验选取小鼠胚胎成骨前体细胞MC3T3-E1作为研究对象,用脂多糖刺激细胞模拟体外炎性微环境,探讨Asxl1基因在炎症环境下对成骨前体细胞的作用,从而为根尖周病骨破坏的防治提供可能的靶向基因。
1材料和方法Materialsandmethods
1.1设计体外实验研究观察。
1.2时间及地点2017至2019年在大连医科大学口腔医学院细胞实验室完成。
1.3材料
1.3.1实验细胞小鼠胚胎成骨前体细胞(MC3T3-E1)购于上海素尔生物科技有限公司。
1.3.2实验仪器和试剂低温离心机、二氧化碳培养箱(Thermo);超净工作台(Boxun);显微照相系统(OLYMPUS);酶标仪、反转录仪(BIO-RAD);PCR仪(TaKaRa);α-MEM培养基(Hyclone);胎牛血清、胰蛋白酶(Gibco);CCK-8(东仁化学科技有限公司);总RNA提取试剂盒(生物工程股份有限公司);反转录试剂盒(TaKaRa);TBGreenTMPremixExTaqTMⅡ(TaKaRa);Asxl1-SiRNA、NegativeControl(NC)(苏州吉玛基因);XfectTMRNATransfectionReagent(TaKaRa)。
1.4实验方法
1.4.1细胞培养以5×105每孔的密度将小鼠胚胎成骨前体细胞MC3T3-E1细胞接种于T25透气培养瓶中,用体积分数为10%胎牛血清、1%双抗的α-MEM培养液对细胞进行培养,置于37℃、体积分数为5%CO2孵箱中孵育,隔天换液,待细胞长满至80%左右,胰酶消化,进行传代,取状态好的细胞用于后续实验。
1.4.2CCK-8检测细胞增殖情况将MC3T3-E1细胞以每孔2000个的密度接种于96孔板中,分别加入0,1,10,20,50mg/L脂多糖刺激MC3T3-E1细胞24h,以筛取最佳作用质量浓度,加入0,20mg/L脂多糖分别刺激0,24,48h,以筛取最佳作用时间。按1∶9(CCK-8溶液∶α-MEM培养基)的比例配置混合溶液,每孔总量100μL(加液时应将液体紧贴孔壁缓慢注入,此过程是为了避免加液过程中气泡的产生,从而防止对实验结果造成误差),37℃、体积分数为5%CO2培养箱内孵育1h,测定吸光度值。
1.4.3免疫荧光检测Asxl1蛋白表达将第3代MC3T3-E1细胞以2×106的密度接种于培养皿,待细胞贴壁并长至细胞与细胞接触且无重叠时进行实验,用0,20mg/L脂多糖刺激MC3T3-E1细胞24h,弃原培养液,PBS清洗3遍,每次5min,40g/L多聚甲醛固定约20min,PBS清洗,0.25%Triton破膜20min,PBS清洗,封闭液封闭20min,一抗(Asxl1PolyclonalAntiboby)4℃过夜,PBS清洗,二抗(山羊抗兔IgG/TRITC)常温避光孵育1h,PBS清洗,DAPI染色8min,PBS清洗去除多余染料,防淬灭封固剂封固,荧光显微镜观察。
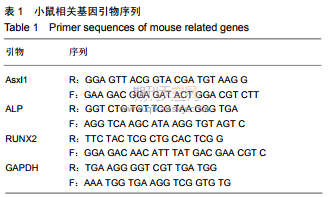
1.4.4RealTime-PCR检测Asxl1mRNA表达将第3代MC3T3-E1细胞以1×106的密度接种于6孔板,待细胞长至80%左右,用0,20mg/L脂多糖刺激MC3T3-E1细胞24h,根据RNA提取试剂盒说明书提取RNA,操作时应注意无菌,以免RNA降解或污染,以该RNA为模板,反转录为cDNA用于后续实验。实验所有引物均由宝生物工程有限公司(TaKaRa公司)代为合成,以GAPDH作为内参引物,序列见表1。
1.4.5基因转染①实验组:Asxl1-SiRNA和转染试剂的混合液(5μLAsxl1-SiRNA+95μLXfect+100μL转染试剂);②阴性对照组:空载对照和转染试剂的混合液(5μL空载对照+95μLXfect+100μL转染试剂);③空白对照组:仅含有转染试剂(100μL转染试剂)。将第3代MC3T3-E1细胞以每孔1×105的密度接种于6孔板中,先用20mg/L脂多糖刺激MC3T3-E1细胞24h,弃原培养液,每孔加1mLα-MEM培养基饥饿培养,配置转染试剂,静置15min后,加入相应孔内;6-8h后换正常培养液,24h后提取样本。按上述CCK-8法检测在脂多糖炎性微环境中沉默Asxl1基因后MC3T3-E1细胞增殖活性,RealTime-PCR检测Asxl1及成骨相关因子ALP和RUNX2mRNA表达水平变化。
1.5主要观察指标①MC3T3-E1细胞处于脂多糖介导的炎性微环境中,Asxl1基因和蛋白的表达水平;②MC3T3-E1细胞在炎性微环境中沉默Asxl1基因后,细胞增殖活性和成骨相关因子ALP、RUNX2基因表达水平。
1.6统计学分析通过SPSS17.0软件,运用one-wayANOVA分析各组实验结果。结果数据按x_±s的形式表示,P<0.05为差异有显著性意义。
2结果Results
2.1CCK-8筛取脂多糖最佳实验质量浓度及实验时间
2.1.1筛取最佳实验质量浓度分别加入0,1,10,20,50mg/L脂多糖刺激MC3T3-E1细胞24h,各实验组分别与0mg/L脂多糖组比较,差异有显著性意义(P<0.05),当质量浓度为1mg/L时细胞增殖活性少量增加,说明低质量浓度脂多糖刺激可能对成骨细胞增殖起促进作用,而当质量浓度为50mg/L时细胞增殖活性降低最明显,但此时对细胞杀伤力较大,为确保后续实验顺利进行,最终确定以20mg/L为最佳实验质量浓度,见图1A。
2.1.2筛取最佳作用时间以0,20mg/L脂多糖分别刺激0,24,48h,结果显示实验组细胞的增殖活性呈降低趋势,差异有显著性意义(P<0.05),且在24h抑制明显,因此确定最佳实验时间24h,见图1B。
2.2免疫荧光检测Asxl1的表达水平免疫荧光结果显示Asxl1在MC3T3-E1中有表达;加入脂多糖刺激后,其表达量明显降低,见图2,提示Asxl1基因可能参与炎症反应过程。
2.3脂多糖作用于成骨细胞后Asxl1mRNA的表达水平与对照组相比,用20mg/L脂多糖刺激MC3T3-E1细胞24h后,Asxl1mRNA表达量明显降低,差异有显著性意义(P<0.05),见图3。
2.4在脂多糖炎性微环境中沉默Asxl1基因后MC3T3-E1细胞增殖活性以及成骨相关因子ALP、RUNX2基因表达水平变化转染Asxl1-SiRNA24h后,实验组分别与阴性对照组、空白对照组相比,MC3T3-E1细胞的增殖活性均明显降低,差异有显著性意义(P<0.05),见图4A。转染Asxl1-SiRNA24h后,实验组分别与阴性对照组、空白对照组相比,Asxl1及成骨细胞相关基因ALP和RUNX2mRNA表达量明显降低,差异有显著性意义(P<0.05),见图4B。
3讨论Discussion
维持骨稳定状态的机制较为复杂,目前已知其不仅与破骨细胞形成、骨吸收增加相关,也与成骨细胞数目减少、分化受到抑制有密不可分的关系。研究发现成骨细胞不仅仅局限于通过促进细胞外骨基质的合成、分泌与矿化而实现新骨的形成[19];它还可积极地调节破骨细胞与造血干细胞在体内的形成与功能,维持机体平衡,同时成骨细胞也是一种内分泌细胞,影响体内能量代谢[20];可参与多条信号通路,例如Wnt/β-Catenin通路和Notch信号通路;ALP和RUNX2是成骨细胞的主要标志性因子,前者可作为成骨早期分化的指标,后者是成骨细胞分化的特异性转录因子[21-23]。由研究可知,骨髓间充质干细胞可向成骨分化,从而形成成骨细胞[24]。骨髓间充质干细胞是具备自我更新及多谱系分化潜能的多潜能干细胞,包括成骨、软骨、脂肪等的形成[25-27],其中骨髓间充质干细胞成骨分化和成脂分化之间的关系对于正常的骨稳态至关重要[28-29]。
近期有研究显示Asxl1无效等位基因的缺失可导致多种骨骼发育缺陷,包括发育不全、骨矿化密度显著降低、眶上脊发育不全等。这种有缺陷的骨骼发育与骨髓间充质干细胞的自我更新受损及谱系调控偏离相关,远离成骨细胞分化而倾向成脂细胞分化[30-31]。Asxl1基因的缺失影响骨髓间充质干细胞的发展命运,而促进骨髓恶性肿瘤的发展[32]。Asxl1基因突变可导致Bohring-Opitz综合征,是一种具有发育迟缓、小头畸形等特点且死亡率极高的罕见遗传病[33-34]。Asxl1对于维持骨髓间充质干细胞正常分化功能及在骨骼发育过程中发挥重要作用,同时Asxl1可能参与骨破坏过程。当骨质处于炎性环境时,也会形成骨破坏。据文献研究报道,炎症环境可通过产生炎症因子,从而抑制成骨细胞的增殖与分化,使得骨平衡遭到破坏,骨质缺失,最终形成骨破坏[35-36]。如炎症因子肿瘤坏死因子α可以降低骨细胞中胶原的产生、骨钙素的合成,从而干扰成骨细胞分化及代谢活性而抑制骨的形成,还能通过抑制Wnt通路,阻断成骨细胞接受机体发出的形成新骨的信号[37-39];白细胞介素1可通过诱导基质酶的产生以及激活NLRP3炎性体,从而对骨组织产生损伤,破坏骨稳态[40-41]。炎症导致的骨破坏机制较为复杂,仍有待进一步研究。实验将探讨Asxl1基因在炎症微环境下对成骨细胞增殖与分化的作用,从而探讨Asxl1基因与骨破坏之间的关系,为根尖周炎骨破坏的研究提供一条新的思路。
相关论文推荐:关节软骨细胞和骨髓间充质干细胞不同共培养方式对细胞增殖与分化的影响
实验选用脂多糖刺激MC3T3-E1细胞建立体外炎性微环境。首先筛取脂多糖最佳质量浓度,设计0,1,10,20,50mg/L浓度梯度进行实验,模拟炎性微环境,在其余条件均相同的情况下刺激细胞24h,CCK-8结果显示脂多糖质量浓度为1mg/L时,细胞的增殖活性与对照组相比升高,随着质量浓度的增加,细胞增殖活性逐渐降低,50mg/L脂多糖时降低最明显,但此时炎性环境对细胞杀伤力较大,为保证后续实验顺利进行,选择20mg/L为最佳质量浓度,该结果提示低质量浓度脂多糖可能对成骨细胞起促进作用,而随着脂多糖质量浓度的持续增加细胞增殖受到抑制,且表现出浓度依赖性;其次筛出脂多糖最佳作用时间,将实验分为2组:MC3T3-E1组(仅含细胞,无脂多糖刺激)和MC3T3-E1+脂多糖组(脂多糖质量浓度为20mg/L),在相同条件下,分别对两组MC3T3-E1细胞刺激0,24,48h,CCK-8结果显示MC3T3-E1+脂多糖组较对照组的细胞增殖活性降低,且与刺激48h相比较,刺激24h时MC3T3-E1细胞的增殖活性降低较明显,推测随着时间的增长可能有其他信号通路参与其中,调控MC3T3-E1细胞增殖。通过检测脂多糖刺激组与正常对照组细胞中Asxl1mRNA的表达,验证Asxl1基因是否受到炎性微环境的影响,结果发现脂多糖刺激组Asxl1基因表达量较正常对照组明显降低,且免疫荧光结果也显示炎性微环境下Asxl1的表达量与正常对照组比较有所减少,说明Asxl1可能参与炎症反应过程。
为进一步验证Asxl1基因在炎性微环境中影响成骨细胞的增殖与分化,实验通过模拟体外炎症微环境,同时在MC3T3-E1细胞中沉默Asxl1基因,结果发现与阴性对照组和空白对照组相比,沉默Asxl1基因后成骨相关基因ALP和RUNX2mRNA的表达量呈降低趋势,细胞增殖活性也降低明显。结果表明,通过抑制Asxl1基因能影响骨形成过程,破坏骨稳态。该结果与ZHANG等[18]学者研究结果一致,他们通过在体内建立Asxl1基因敲除模型,发现在不同条件下体内模型均表现出不同程度的骨质缺失及骨质发育不全。
实验主要的不足之处:一是未研究Asxl1基因与破骨细胞之间的关系,因为骨稳态不仅与成骨细胞有关,与破骨细胞也有密切联系,只有新骨不断的形成与旧骨不断的破坏处于动态平衡时,骨质才能正常代谢;二是实验未建立小鼠体内根尖周炎模型,没有对Asxl1基因是否通过参与炎症反应过程影响成骨细胞增殖分化加以验证;三是实验未进行蛋白层面的研究。探讨Asxl1基因与根尖周炎骨破坏之间的关系,可为临床根治根尖周炎提供靶向基因,但Asxl1基因与根尖周炎骨破坏之间仍有较多问题存在,这将是实验室继续研究的重点与方向。
综上所述,Asxl1基因参与骨质形成过程,在炎症微环境下,Asxl1基因的减少可进一步抑制成骨细胞的增殖与分化从而破坏骨稳态,引起骨破坏,导致根尖周炎。但Asxl1基因与根尖周炎骨破坏之间尚存疑点,有待进一步研究,从而为根尖周病的防治提供可能的靶向基因。
声明:①文献来自知网、维普、万方等检索数据库,说明本文献已经发表见刊,恭喜作者.②如果您是作者且不想本平台展示文献信息,可联系学术顾问予以删除.

SCISSCIAHCI