0
发表咨询在线!

发布时间:2020-02-24所属分类:医学论文浏览:1次
摘 要: 摘要背景:研究表明双硫仑本身具有抗肿瘤活性,可联合铜(Cu)离子在体内外水平对多种肿瘤发挥抑癌作用,但关于双硫仑对骨肉瘤细胞增殖和凋亡作用的影响尚未阐明。 目的:探讨双硫仑-Cu 在体内外水平对骨肉瘤增殖与凋亡能力的影响以及可能的作用机制。 方法:

摘要背景:研究表明双硫仑本身具有抗肿瘤活性,可联合铜(Cu)离子在体内外水平对多种肿瘤发挥抑癌作用,但关于双硫仑对骨肉瘤细胞增殖和凋亡作用的影响尚未阐明。
目的:探讨双硫仑-Cu 在体内外水平对骨肉瘤增殖与凋亡能力的影响以及可能的作用机制。
方法:实验方案经山西医科大学动物实验伦理委员会批准(批准号为 2017LL077)。①体外实验:配置双硫仑在进入人体后的转换物二乙基二硫代氨基甲酸钠(diethyldithiocarbamate,DDTC)和 Cu 离子的复合物 DDTC-Cu(0.5,1,2,3 和 5 μmol/L),设置 DDTC 单药(5 μmol/L)、Cu 单药(5 μmol/L)和空白对照组。药物处理人骨肉瘤细胞 Saos-2 细胞和 MG-63 细胞,CCK8 法检测不同浓度 DDTC-Cu 对 Saos-2 细胞和 MG-63 细胞的增殖抑制作用;采用 AnnexinV-FITC/PI 双染法检测 DDTC-Cu 对 Saos-2 细胞凋亡水平变化;②体内实验:取 4 周龄 BALB/c-nu/nu 雌性裸鼠共 10 只,随机分为 DDTC-Cu 组和对照组。采用异位移植方法,在裸鼠右侧背部皮下注射 Saos-2 细胞和 Matrigel 混悬液(1∶1 混合),注射量 400 μL/只;接种 2 周后,对照组裸鼠腹腔注射地塞米松(0.5 mg/kg,隔日 1 次),DDTC-Cu 组裸鼠腹腔注射地塞米松(0.5 mg/kg,隔日 1 次) 和 DDTC-Cu 复合物(10 nmol/g,隔日 1 次);观察两组荷瘤小鼠移植瘤生长情况,绘制瘤体生长曲线。接种 5 周后麻醉下处死动物,完整取出瘤体,免疫组织化学检测瘤体石蜡切片组织中 ki67 蛋白的表达水平,Western blot 检测瘤体组织中细胞增殖和凋亡蛋白的表达及 JNK 通路蛋白表达的变化。结果与结论:①体外实验结果:DDTC-Cu 组对骨肉瘤细胞的增殖抑制作用明显高于其他 3 组;CCK-8 实验结果显示DDTC-Cu对骨肉瘤细胞增殖抑制呈剂量依赖性,两株细胞的24 h药物半抑制浓度分别为0.337 μmol/L 和 0.487 μmol/L;流式细胞学检测结果显示 DDTC-Cu 可呈剂量依赖性促进 Saos-2 细胞的凋亡;②体内实验结果:DDTC-Cu 组裸鼠移植瘤的体积和质量均小于对照组;免疫组织化学结果显示,DDTC-Cu 组的瘤体中 ki-67 蛋白表达水平较对照组降低;Western blot 检测结果显示,DDTC-Cu 组瘤体蛋白中 p-JNK 和 c-jun 的表达水平均上调。结果提示,双硫仑联合 Cu 离子在体内外水平抑制人骨肉瘤细胞增殖并促进骨肉瘤细胞凋亡,其作用机制可能与 JNK 通路活化有关。
关键词:双硫仑;铜;骨肉瘤;增殖;凋亡;JNK 通路
0 引言
Introduction 骨肉瘤是最常见的原发性恶性骨肿瘤,好发于青少年,其恶性程度高、侵袭性强、复发和转移率高。近年来,随着辅助化疗及外科应用水平的提高,骨肉瘤的治疗效果已有明显改善,但其术后局部复发率高达10%-20%[1- 2],严重的是有近一半的骨肉瘤患者出现转移,主要发生肺转移,且约有80%发生转移的患者在5年内死亡[3]。借助分子生物学、免疫学等有利工具,发掘新的生物标志物和治疗靶点对骨肉瘤的有效诊断和治疗具有重要临床意义。近年来对 “老药新用”的研究已成为国际抗肿瘤研究的热点之一。双硫仑又名戒酒硫,于1948年由哥本哈根的JACOBSEN 等发现,是一种能够抑制醇乙醛脱氢酶的二硫代氨基甲酸盐药物,可致酒精代谢产物乙醛在体内蓄积并产生氧化反应,使患者对饮酒产生负面反射,从而达到戒酒治疗的目的。LEE等[4]发现,双硫仑可通过联合放射治疗,增强非典型畸胎横纹肌样瘤干细胞凋亡和自噬,抑制肿瘤生长。双硫仑-Cu可通过影响肿瘤细胞蛋白酶活性进而抑制胰腺癌细胞的增殖[5]。但双硫仑在骨肉瘤中是否发挥抑癌作用,目前尚不明确。研究通过合成双硫仑在进入人体后的转换物二乙基二硫代氨基甲酸钠(diethyldithiocarbamate, DDTC)与Cu的复合物,使研究方法更接近临床患者体内水平层面,从体外和体内实验分别验证双硫仑对骨肉瘤增殖和凋亡的作用,为骨肉瘤将来临床分子靶向治疗和药物研发提供科学理论依据。
1 材料和方法 Materials and methods
1.1 设计 体外水平进行分子生物学实验,动物模型体内验证。
1.2 时间及地点 实验于2018年2月至12月在山西医科大学第二医院骨与关节损伤山西省重点实验室完成。 1.3 材料 1.3.1 人骨肉瘤细胞细胞系 Saos-2和MG-63购自美国模式培养物集存库(American Type Culture Collection, ATCC)。
1.3.2 实验用主要试剂 RPMI 1640培养基、胎牛血清 (FBS) 和 胰 蛋 白 酶 消 化 液 购 自 Gibco 公司。 DDTC (C5H10NS2·Na·3H2O)、二氯化铜(CuCl2·2H2O)和亚硫酸钠 (Na2SO3)购自Sigma-Aldrich公司。CCK8试剂盒购自博士德。Annexin V-FITC/PI细胞凋亡检测试剂盒购自凯基生物。锥虫蓝染色细胞存活率检测试剂盒购自博士德公司。Matrigel胶、6孔板和96孔板购自美国Corning公司。PCNA、 Cleaved Caspase-3、PARP、GAPDH和β-actin抗体购自 Cell Signaling Technology公司,ki-67、p-JNK和p-c-jun 抗体购自Santa Cruz Biotechnology公司。
1.3.3 实验动物 4周龄BALB/c-nu/nu雌性裸鼠购自北京维通利华实验动物技术有限公司,体质量15-20 g,生产许可证号:SCXK(京)2014-0006,使用许可证号:SYXK(晋) 2015-0001。
1.4 实验方法
1.4.1 细胞培养 取液氮中冻存的细胞复苏,加入含体积分数10%FBS、1%青链霉素的RPMI 1640完全培养液,置于37 ℃、体积分数5%CO2和9%湿度培养箱中培养。取处于对数生长期细胞,弃瓶内培养液,用PBS(0.01 mol/L) 清洗2遍,加入含乙二胺四乙酸(EDTA)胰蛋白消化酶 (0.25%)1 mL,静置2 min,镜下观察细胞逐渐变圆或有细胞脱落时加入完全培养液终止消化,吹打管轻柔吹打细胞悬液后传代。
1.4.2 化学药物合成 首先将DDTC、CuCl2和Na2SO3溶于无菌水,分别制备成200 mmol/L浓度的溶液。再取上述 50 μL DDTC溶液、25 μL Na2SO3溶液和50 μL CuCl2溶液加至9 mL无菌水中,轻混匀。最后加入无菌水至混匀液,使总量达到10 mL,轻混匀,制备成终浓度为1 mmol/L的 DDTC-Cu复合物,4 ℃保存。实验中用于细胞实验及动物注射的DDTC和Cu的浓度均为1 mmol/L[5]。
1.4.3 细胞增殖-毒性检测 半抑制浓度(IC50)数值由剂量反应曲线得出。抑制率按公式抑制率(%)=[(对照孔-实验孔)/(对照孔-空白孔)]×100%计算。根据两株细胞的IC50结果,选取抑制效率高的细胞进行后续动物实验。采用CCK-8 法,收集对数期细胞,调整细胞悬液浓度,96孔板每孔加入 100 μL,使待测细胞调浓度至(1×103 -1×104 )/孔,常规培养 24 h,设置对照组,DDTC-Cu组(0.5,1,2,3和5 μmol/L)、 DDTC组(5 μmol/L)和Cu组(5 μmol/L),对照组仅加入完全培养液,空白孔内为不含细胞和待测物质的培养基用于去除实验背景干扰。每孔加入10 μL CCK-8溶液,培养箱内孵育2 h,用酶标仪检测450 nm处吸光度值[D(450)]。
1.4.4 流式检测细胞凋亡 采用AnnexinV-FITC/PI双染法,消化重悬离心收集细胞,用PBS洗涤细胞2次,收集1×105细胞,加入500 μL的Binding Buffer悬浮细胞,再分别加入5 μL的AnnexinV-FITC和Propidium Iodide试剂混匀。室温避光反应10 min后进行流式细胞仪检测。
1.4.5 锥虫蓝染色检测活细胞生存率 采用锥虫蓝染色试剂盒,消化离心收集细胞,用2 mL细胞稀释液重悬细胞。各取100 μL的细胞重悬液和锥虫蓝(2X)染液,加入EP管中轻混匀,3 min内用血细胞计数板计数活细胞和死细胞。活细胞率(%)=[(细胞总数-死细胞数)/细胞总数]×100%计算。
1.4.6 动物实验 4-6周龄雌性BALB/c裸鼠购自北京维通利华公司,体质量15-20 g,共10只,随机分为DDTC-Cu 组和对照组,每组5只。麻醉裸鼠后,在右侧背部皮下用提前预冷的微量进样器和29G针头,注射Saos-2细胞和 Matrigel混悬液(1∶1混合),注射量为每只400 μL[6]。接种 2周后,对照组裸鼠腹腔注射地塞米松(0.5 mg/kg,隔日1 次),DDTC-Cu组裸鼠腹腔注射地塞米松(0.5 mg/kg,隔日 1次)和DDTC-Cu复合物(10 nmol/g,隔日1次)。每3 d测量瘤体的长度(L)、宽度(W),体积大小按公式:V=1/2LW2进行计算。接种5周后,麻醉后完整取出瘤体,称质量拍照后固定在多聚甲醛溶液中24 h,石蜡包埋切片,常温保存。
1.4.7 免疫组织化学检测瘤体组织中ki-67的表达 动物瘤样本常规脱水石蜡包埋,病理切片,组织厚度5 μm。切片常规脱蜡至水,抗原采用热修复。一抗(ki-67抗体)4 ℃ 孵育过夜,阴性对照组为加入PBS代替一抗。自然晾干滴后加二抗室温孵育15 min。DAB显色,最后脱水透明,封固镜检。采用全自动玻片扫描仪(3DHISTECH)检测,扫描控制软件计数阳性细胞数。
1.4.8 Western Blot检测瘤体组织中增殖细胞核抗原 PCNA、凋亡蛋白Cleaved Caspase-3、Cleaved PARP及通路蛋白anti-p-JNK和p-c-jun的表达 取瘤体组织蛋白提取液,BCA法检测蛋白浓度,-80 ℃保存备用。蛋白混匀 4×Loading Buffer后100 ℃煮10 min,按每上样孔50 μg加入至10%分离胶中,电泳转膜,5%脱脂奶粉TBST封闭,一抗(anti-PCNA:cat. 2586,1∶2 000稀释;anti-Cleaved Caspase-3:cat. 9664,1∶1 000稀释;anti-Cleaved PARP:cat. 5625,1∶800稀释;anti-GAPDH:cat. 5174, 1∶800稀释;anti-β-actin:cat. 4970,1∶1 000稀释; anti-ki-67 : sc-23900 , 1 ∶ 500 稀 释 ; anti-p-JNK : sc-293136,1∶500稀释;anti-p-c-jun:sc-53182,1∶200 稀释)4 ℃过夜孵育。TBST洗膜3次后孵育二抗,ECL发光检测。实验重复3次,采用Image J软件测量灰度值。
1.5 主要观察指标 ①体外实验检测DDTC-Cu对骨肉瘤细胞增殖的抑制作用和促进骨肉瘤细胞凋亡的作用;②体内实验检测DDTC-Cu对瘤体生长的影响,并检测瘤体组织中DDTC-Cu对增殖蛋白PCNA、ki-67、凋亡蛋白Cleaved Caspase-3、Cleaved PARP和信号通路蛋白anti-p-JNK和 p-c-jun的影响。
1.6 统计学分析 使用SPSS 20.0统计软件分析,瘤体质量和体积数据呈正态分布,以x _ ±s表示,两组间比较采用t检验,多组间比较采用单因素方差分析,两两间比较采用 SNK-q检验;应用GraphPad Prism 5软件绘制剂量反应曲线和瘤体生长曲线图,检验水准:α=0.05。
相关知识推荐:抗肿瘤的论文可以投哪些杂志
2 结果 Results
2.1 体外实验结果
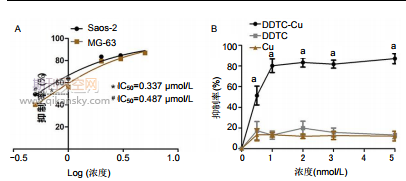
2.1.1 IC50拟合曲线结果 Saos-2细胞和MG-63细胞的 24 h的IC50分别为0.337 μmol/L和0.487 μmol/L。选取药物抑制率更高的Saos-2细胞进行后续动物实验。采用CCK-8 法 检 测 DDTC-Cu 对 细 胞 增 殖 抑 制 的 剂 量 依 赖 性 。 DDTC-Cu(5 μmol/L)对骨肉瘤细胞的抑制作用较对照组、 DDTC组和Cu组均明显增强,见图1。
2.1.2 AnnexinV-FITC/PI双染结果 DDTC-Cu诱导24 h 后,流式细胞仪检测结果显示,在MG-63细胞中,DDTC-Cu 在浓度为0,1,3和5 μmol/L的凋亡率分别为(7.037± 0.502)%,(9.013±0.428)%,(13.180±0.654)%和(14.420± 0.197)%。在Saos-2细胞中,DDTC-Cu在浓度为0,1,3 和5 μmol/L 的凋亡率分别为(7.433±0.493)%,(10.70± 0.30)% , (12.700±0.361)% 和 (15.10±0.10)% 。 并 且 , DDTC-Cu诱导24 h后细胞出现胞体变圆、缩小和脱落。锥虫蓝染色显示随DDTC-Cu浓度升高,活细胞越少,见图2。
2.2 体内实验结果
2.2.1 肿瘤体积及质量比较 裸鼠接种细胞2周后,随机分为DDTC-Cu组和对照组。接种Saos-2细胞5周后,对照组肿瘤体积较DDTC-Cu组明显增大[(2 638.0±767.2)vs. (507.8±93.6) mm3 ]。取出瘤体称质量,结果显示对照组瘤体质量明显重于DDTC-Cu组(2.950±0.843) vs. (1.413± 0.295) mm3,见图3。
2.2.2 免疫组织化学检测结果 裸鼠荷瘤组织中ki-67的表达差异,结果显示DDTC-Cu组瘤体内ki-67阳性蛋白表达量明显低于对照组,见图4。
2.2.3 Western blot检测裸鼠瘤体组织中增殖蛋白、凋亡蛋白和通路蛋白的表达 结果显示DDTC-Cu组的PCNA 蛋白表达低于对照组,而凋亡蛋白Cleaved Caspase-3、 Cleaved PARP和通路蛋白anti-p-JNK和p-c-jun的表达均高于对照组,见图5。
3 讨论 Discussion
骨肉瘤目前标准的治疗方法包括手术切除和全身化疗,然而这些治疗方法的疗效有限,特别是对于转移或复发性骨肉瘤患者,预后较差[7]。实际上,有耐药性或转移性骨肉瘤患者的5年生存率不足30%[8],并且现用的化疗药物靶向性差,可能会引起许多严重不良反应[9]。化疗药物的毒副作用和耐药特性严重影响骨肉瘤疗效的进一步提高,从安全评估较成熟且廉价药物中开发能够抗骨肉瘤活性的新用途,近年来已引起广泛学者关注。
双硫仑是一种广泛用于治疗慢性酒精上瘾以及古柯碱的戒断药物,近年来,双硫仑与Cu的螯合剂在抗肿瘤过程中发挥着重要作用,“老药新用”开始得到学者重视。多项研究报道,双硫仑可通过螯合Cu离子,对多种肿瘤细胞发挥抑制增殖且诱导凋亡的抑癌作用。Cu离子被证实可参与机体内的氧化还原反应,不仅可导致DNA的损伤,还可诱导蛋白质和脂质变性,导致细胞凋亡[10]。YANG等[11]发现,双硫仑-Cu通过改变鼻咽癌CNE-2Z细胞的细胞形态和膜超微结构,影响癌细胞的迁移、黏附和凋亡能力进而影响肿瘤进程。体内外实验证明双硫仑-Cu可通过抑制ALDH2 的表达,逆转癌细胞对微管抑制剂的耐药性,使得化疗药物易产生耐药性得以转归[12]。另外双硫仑-Cu对非小细胞肺癌细胞具有显著的细胞毒性和caspase依赖性凋亡,并能在细胞质中形成空泡,证实其促肿瘤细胞凋亡能力[13]。另有研究表明,双硫仑可通过 ERK/NF-κB/Snail信号通路抑制由转化生长因子β介导的上皮间充质转化,进而发挥抑制乳腺癌的侵袭作用[14]。但双硫仑在骨肉瘤中是否扮演抑癌角色,目前尚不明确。
双硫仑是二硫代氨基甲酸盐,水溶性极差。研究人员在进行实验时,普遍将其溶于含硫有机化合物二甲基亚砜中,达到水溶效果[15-16]。但二甲基亚砜在高温下有分解现象,遇氯能发生剧烈反应并且存在一定的毒性[17]。研究显示双硫仑在进入人体后会迅速转化为体内代谢物DDTC, Cu可与DDTC结合形成较稳定的DDTC-Cu复合物[5],使得研究对象和方式更接近体内状态水平。并有学者发现在 Wilson病中,不论在实验组还是对照组,Cu的含量均不会大幅增加,证实体内注射的Cu仍受机体新陈代谢的调节[18-19]。故此次研究使用合成的DDTC-Cu复合物进行相关研究。此次研究首先通过体外实验证实DDTC-Cu可呈剂量依赖性抑制骨肉瘤细胞增殖,并促进骨肉瘤细胞凋亡。进一步的体内实验得到与体外实验相同结果,DDTC-Cu可抑制荷瘤小鼠瘤体的生长。
目前双硫仑的抗肿瘤机制与ROS-NFκB 信号通路活化有关 。研 究表 明双 硫仑 -Cu的抗肿 瘤能 力可 能与 NF-kappaB、ROS及JNK通路有关[11,20]。KIM等[21]指出JNK 信号通路的持续活化在人类肿瘤细胞凋亡进程中发挥促凋亡作用。JNK信号通路是MAPKs信号转导通路,在凋亡的启动过程中扮演重要角色。另外,外源性肿瘤坏死因子α 可通过P-JNK/SAPK途径导致人髓核细胞凋亡[22]。目前双硫仑的抗肿瘤机制也与其可形成高效的蛋白酶体抑制剂有关。双硫仑与Cu的螯合物则是十分高效的蛋白酶体抑制剂之一,可通过抑制肿瘤细胞蛋白酶的活性进而促进凋亡发生。研究表明,双硫仑与Cu结合后可通过抑制结肠癌细胞中蛋白酶的活性促进细胞凋亡[23]。此次研究通过提取动物模型瘤体蛋白,结果发现DDTC-Cu可抑制增殖蛋白PCNA 的表达,促进凋亡蛋白Cleaved Caspase-3和Cleaved PARP、JNK信号通路蛋白及下游底物p-c-Jun的表达。另外免疫组织化学检测瘤体中增殖蛋白ki-67的表达,结果同样显示DDTC-Cu组瘤体内ki-67阳性蛋白表达量明显高于对照组。
综上,双硫仑可与Cu结合可在体外和体内水平抑制骨肉瘤细胞增殖,其机制可能是通过活化JNK信号通路促进骨肉瘤细胞凋亡。研究后续会优化双硫仑给药途径,并进行临床骨肉瘤样本验证及机制探索,为双硫仑未来能在临床骨肉瘤治疗中“老药新用”并阐明机制方面提供科学理论依据。
澹版槑:鈶犳枃鐚潵鑷煡缃戙€佺淮鏅€佷竾鏂圭瓑妫€绱㈡暟鎹簱锛岃鏄庢湰鏂囩尞宸茬粡鍙戣〃瑙佸垔锛屾伃鍠滀綔鑰�.鈶″鏋滄偍鏄綔鑰呬笖涓嶆兂鏈钩鍙板睍绀烘枃鐚俊鎭�,鍙仈绯�瀛︽湳椤鹃棶浜堜互鍒犻櫎.

SCISSCIAHCI