0
发表咨询在线!

发布时间:2020-02-24所属分类:医学论文浏览:1232次
摘 要: 摘要背景:如何增强骨髓间充质干细胞增殖活性使其移植后发挥应有的疗效是目前急需解决的问题。 目的:探讨体外负压培养技术对小鼠骨髓间充质干细胞增殖活性及血管内皮生长因子分泌水平的影响。 方法:取第 3 代骨髓间充质干细胞,给予间歇性负压培养(-6.65,

摘要背景:如何增强骨髓间充质干细胞增殖活性使其移植后发挥应有的疗效是目前急需解决的问题。
目的:探讨体外负压培养技术对小鼠骨髓间充质干细胞增殖活性及血管内皮生长因子分泌水平的影响。
方法:取第 3 代骨髓间充质干细胞,给予间歇性负压培养(-6.65,-13.3,-26.6 kPa),2 h/次,1 次/12 h,对照组在正常条件下培养。培养 12,24,36,48,60 h,采用 CCK-8 法检测细胞增殖情况,ELISA 检测细胞分泌血管内皮生长因子水平,RT-PCR 检测血管内皮生长因子受体 mRNA 表达。根据上述结果,选择一个最佳负压条件和时间(-26.6 kPa,24 h),将骨髓间充质干细胞分为正常对照组、负压组、负压+血管内皮生长因子受体抑制剂 Axitinib 组,CCK-8 法检测细胞增殖情况,EDU 试剂盒检测 EDU 细胞阳性率,结晶紫染色观察细胞集落形成单位。结果与结论:①与对照组比较,3 个负压干预组骨髓间充质干细胞显著增殖(P < 0.05);②与对照组比较,3 个负压干预组细胞分泌血管内皮生长因子水平显著增高(P < 0.05),血管内皮生长因子受体 mRNA 表达显著增高(P < 0.05);③经血管内皮生长因子受体抑制剂处理后,细胞增殖吸光度值、克隆形成单位数量及 EDU 阳性细胞率较负压干预组明显降低;④结果表明,体外负压培养可能通过上调血管内皮生长因子分泌水平促进骨髓间充质干细胞增殖。
关键词:骨髓间充质干细胞;负压培养;细胞增殖;血管内皮生长因子;血管内皮生长因子受体;克隆形成单位
0 引言 Introduction
德国病理学家Cohnheim在研究伤口愈合时首次提出骨髓中存在非造血干细胞的观点,并指出成纤维细胞可能来源于骨髓[1]。FRIEDENSTEIN在20世纪60年代的一系列研究中证实了骨髓中的细胞能够附着在组织培养板的表面,并能形成骨骼组织,包括骨和软骨。除骨髓之外,在其他许多组织中也存在这种细胞,如外周血、脂肪组织、羊膜和脐血等[2-3]。骨髓间充质干细胞具有增殖和分化为多种细胞的潜能,已成为组织工程和再生医学中一种很有前景的细胞来源[4-5]。一方面,骨髓间充质干细胞经培养扩增后移植到体内或种植于三维生物材料支架中,能够形成新的组织,为临床应用做准备[6-7];另一方面,骨髓间充质干细胞移植到体内,能够分泌胰岛素样生长因子、血管内皮生长因子、转化生长因子β1等营养因子[8]。例如,骨髓间充质干细胞移植治疗急性心肌梗死,有助于提高瘢痕心肌的顺应性,改善心功能[9-10]。LIAO等[11]研究表明,骨髓间充质干细胞通过免疫调节和旁分泌效应促进血管生成,改善心力衰竭患者心脏功能。
心力衰竭患者心脏功能。虽然以骨髓间充质干细胞为基础的治疗方法有望用于疾病的治疗,但在该细胞能够广泛应用于临床之前,仍然存在一些挑战。首先,骨髓间充质干细胞仅占骨髓单个核细胞的0.01%,从骨髓中获取细胞后,需要对其进行扩增才能获得足够数量的细胞,以供后续应用,例如,大多数组织工程应用都需要数百万间充质干细胞;其次,干细胞移植后存活率低,即绝大多数细胞在移植后数小时内死亡。如 MüLLER-EHMSEN等[12]报道植入免疫缺陷小鼠心脏模型中的外源性骨髓间质干细胞在4 d内仅有不到0.4%存活,这些问题源于细胞增殖活性和多向分化潜能发生改变,极大地影响了治疗效果,限制了其在组织再生、免疫调节方面的应用。
推荐阅读:快速发表的医学类普刊
为了在体外维持骨髓间充质干细胞的多向分化潜能和增殖活性,已经进行了细胞内和细胞外的干预方法。细胞内干预方法主要是通过基因改造来实现的,而细胞外干预方法主要是通过优化培养条件来实现的。然而,基因修饰的细胞很可能发生突变,降低了临床应用的安全性。负压吸引技术是一种物理刺激方式,目前有关体外负压培养技术对间充质干细胞增殖影响的研究较少。研究表明,血管内皮生长因子可以促进间充质干细胞增殖[13]。实验拟采用负压体外培养骨髓间充质干细胞,探讨细胞增殖情况以及血管内皮生长因子分泌水平,并初步分析细胞增殖指数与血管内皮生长因子分泌水平相关性。
1 材料和方法 Materials and methods
1.1 设计 细胞学实验。
1.2 时间及地点 实验于2017年11月至2018年11月在石河子大学转化医学动物实验室完成。
1.3 材料
1.3.1 实验动物 C57BL/6小鼠24只,SPF级,雌雄不限, 4-6周龄,购自新疆医科大学实验动物中心。
1.3.2 实验试剂和仪器 低糖DMEM、胰蛋白酶(美国 Gibco 公 司 ) ; 胎 牛 血 清 ( 美 国 Hyclone 公 司 ) ; TRIzol Reagent(美国Invitrogen公司);cDNA合成试剂盒(美国 Thermo公司);荧光定量PCR试剂盒(美国Qiagen公司);血管内皮生长因子ELISA试剂盒(武汉伊莱瑞特生物科技有限公司);血管内皮生长因子受体抑制剂Axitinib(Selleck公司); EDU试剂盒(碧云天生物科技有限公司);PCR仪(美国 Thermo公司);血管内皮生长因子受体引物(上海生工公司)。
1.4 实验方法
1.4.1 骨髓间充质干细胞原代培养与鉴定 参照课题组前期研究方法[14-15]。C57BL/6小鼠给予10%水合氯醛麻醉,颈椎脱臼法处死,乙醇消毒后置于超净台上,无菌条件下取出双侧股骨和胫骨,剔除两端骨质。用无菌注射器抽取骨髓间充质干细胞培养基约5 mL(含体积分数为10%胎牛血清的LG-DMEM),立即更换1 mL无菌注射器针头,反复冲洗骨髓腔,直至骨髓腔变为白色。将冲洗出的骨髓液吹打均匀后接种于60 mm无菌培养皿中,置于37 ℃、体积分数为5%CO2培养箱中培养48 h,PBS清洗2次,去除悬液中未贴壁细胞,加入新鲜配制的LG-DMEM培养基3 mL,隔日换液。待细胞生长至80%-90%融合时,弃去培养基,加入含0.25%EDTA的胰蛋白酶1 mL消化,显微镜下可见细胞回缩变圆、细胞间隙出现时,用含体积分数为10%胎牛血清的LG-DMEM培养基终止消化,用移液枪轻轻吹打,直至培养皿上大部分细胞脱落。收集细胞,1 000 r/min离心5 min,弃去上清液,用1 mL LG-DMEM完全培养基重悬细胞。将细胞悬液均匀接种至2个新培养皿中,按1∶2进行传代培养,取传3代细胞用于后续研究。
将第3代骨髓间充质干细胞接种于6孔板中,每孔加入 2 mL间质干细胞完全培养基,放入37 ℃,体积分数为 5%CO2孵箱中培养。待细胞达到80%-90%融合时,吸去旧培养液,每孔加入2 mL成骨诱导分化完全培养基,每3 d 换液1次,共换液7次。诱导21 d,镜下观察形成钙结节,进行茜素红染色,简要步骤:小心轻缓倒去培养夜,加入 PBS轻缓漂洗,体积分数为10%中性甲醛固定30 min,加入约1 mL茜素红染液覆盖孔底,染色5 min左右,吸去染液,加入PBS轻缓漂洗,
1.4.2 细胞准备 将准备好的第3代骨髓间充质干细胞加入1 mL胰蛋白酶(含0.25%EDTA)消化,置于荧光倒置显微镜下观察细胞形态收缩且少量开始漂浮,加入含体积分数为 10%胎牛血清的LG-DMEM培养基2 mL终止消化,使用1 mL 移液枪轻轻均匀吹打并收集于15 mL无菌离心管中, 1 000 r/min离心5 min收集细胞,吸弃上清,加入1 mL含体积分数为10%胎牛血清的DMEM培养基或含体积分数为 10%胎牛血清、内皮生长因子受体抑制剂的DMEM培养基重悬,吸取10 μL细胞悬液冲池细胞计数板,显微镜下行细胞计数,以3×105 /孔接种于6孔细胞培养皿中,震荡混匀后,补充培养基至2 mL,标记并放入37 ℃、体积分数为5%CO2 培养箱中培养12 h备用;以3×103 /孔接种于96孔细胞培养皿中,震荡混匀后,补充培养基至100 μL,标记并放入37 ℃、体积分数为5%CO2培养箱中培养12 h备用。将20个6孔板和 96孔板分别随机分成对照组、-6.65 kPa组、-13.3 kPa组、 -26.6 kPa组,每组均有5个6孔板和5个96孔板。
1.4.3 细胞负压培养 自制负压吸引装置:由一个吸痰机和一个负压可调节吸引器及一个密闭的容器盒组成。各实验组进行间歇性负压培养,其中低负压组预处理负压压力为-6.65 kPa、中负压组预处理负压压力为-13.3 kPa、高负压组预处理负压压力为-26.6 kPa,对照组为放置在培养箱中普通培养。在上述可调剂负压装置的培养箱中培养12, 24,36,48,60 h,负压时间为2 h/次,每12 h 1次。
1.4.4 CCK-8细胞增殖实验 在96孔板中接种细胞悬液 (100 mL/孔),放在37 ℃、体积分数为5%CO2培养箱进行间歇性负压培养,向每孔加入10 mL的CCK-8溶液(注意不要在孔中生成气泡,它们会影响吸光度值读数),在培养箱内孵育3 h,用酶标仪测定450 nm处的吸光度值。
1.4.5 RT-PCR 检测骨髓间充质干细胞中血管内皮生长因子受体mRNA表达 上述各组细胞负压培养结束后 12 h,Trizol提取细胞总RNA,采用Nanodrop 2000(Thermo Fisher公司,美国)测量吸光度A260/A280,检测RNA样本浓度和纯度,取200 ng总RNA反转录合成cDNA,加入PCR 仪中扩增(95 ℃预变性2 min,95 ℃变性5 s,55 ℃退火 30 s,60 ℃延伸10 s,共40个循环)。以β-actin作为内参,结果采用实时荧光定量PCR分析程序分析Ct值,采用2 -ΔΔCt 法计算目的基因mRNA相对表达量。引物序列:β-actin上游引物:5'-TTC CTT CTT GGG TAT GGA AT-3',下游引物:5'-GAG CAA TGA TCT TGA TCT TC-3';血管内皮生长因子受体上游引物:5'-ATC TTC AAG CCG TCC TGT GTG-3',下游引物:5'-AGG TTT GAT CCG CAT GAT CTG-3'。
1.4.6 各组细胞培养上清液的提取 将准备好的第3代骨髓间充质干细胞以3×105 /孔接种于6孔细胞培养皿中,震荡混匀后,补充培养基至2 mL,标记并放入37 ℃、体积分数为5%CO2培养箱中培养12 h,每孔添加2 mL不含血清不含生长因子的DMEM培养液,各组给予对应的负压条件,负压干预结束后12 h,收集上清,以3 000 r/min离心 10 min,得到的上清液即为骨髓间充质干细胞培养上清液,离心后用于下一步ELISA检测,简要步骤:将待测样品与血管内皮生长因子标准品加入包被有血管内皮生长因子抗体的96孔板中,37 ℃孵育1 h;加入100 μL检测溶液A, 37 ℃孵育1 h;加入100 μL检测溶液B,37 ℃孵育1 h;然后加入底物溶液90 μL,37 ℃避光显色15-20 min。当标准品孔呈现明显梯度蓝色时,加入终止液50 μL终止反应。酶标仪450 nm波长处检测各孔吸光度值,绘制标准曲线,通过标准曲线方程计算待测样本血管内皮生长因子水
1.4.7 EDU标记及固定、洗涤和通透 将第3代骨髓间充质干细胞以3×105 /孔接种于6孔细胞培养皿中,负压干预结束(-26.6 kPa干预24 h)后12 h后加入EDU继续孵育2 h。 EDU标记细胞完成后,去除培养液,加入1 mL固定液(40 g/L 多聚甲醛),室温固定15 min,然后每孔用1 mL洗涤液洗涤细胞3次,每次3-5 min;去除洗涤液,每孔用1 mL通透液(含 0.3% Triton X-100的PBS)室温孵育10-15 min;去除通透液,每孔用1 mL洗涤液洗涤细胞一两次,每次3-5 min;每孔加入0.5 mL Click反应液,轻轻摇晃培养板以确保反应混合物可以均匀覆盖样品,室温避光孵育30 min;吸除Click 反应液,用洗涤液洗涤3次,每次3-5 min;吸除洗涤液后,每孔加入1×Hoechst 33342溶液1 mL,室温避光孵育 10 min;吸除1×Hoechst 33342溶液,用洗涤液洗涤3次,每次3-5 min,随后即可进行荧光检测。Hoechst33342为蓝色荧光,最大激发波长为346 nm,最大发射波长为460 nm。 1.4.8 克隆形成实验 将第3代骨髓间充质干细胞以500 个/孔接种6孔培养板,每组设3个复孔,培养孔内为含体积分数为10%胎牛血清的完全培养基;培养12 h待细胞贴壁后,进行下列处理。将6孔板内培养基均弃掉,然后向6孔板第1孔加入2 mL含体积分数为10%胎牛血清的DMEM培养基,第2孔加入2 mL含体积分数为10%胎牛血清的 DMEM培养基,第3孔加入2 mL含终浓度为50 μmol/L Axitinib、体积分数为10%胎牛血清的DMEM培养基,加样完毕后,完全混匀,并分组标记为对照组、负压组、血管内皮生长因子受体抑制剂组,每组3个复孔。
上述6孔板在37 ℃、体积分数为5%CO2培养箱中连续培养48 h,吸弃原培养基,加入2 mL含体积分数为10%胎牛血清的DMEM培养基,在37 ℃、体积分数为5%CO2培养箱中给予-26.6 kPa干预培养24 h,对照组正常培养 24 h。每隔3 d进行换液并观察细胞状态,培养7 d后弃掉培养基,PBS洗涤细胞1次,每孔加入1 mL 40 g/L多聚甲醛,4 ℃冰箱固定60 min,PBS洗涤细胞1次,每孔加入洁净、无杂质结晶紫染液1 mL,染细胞2 min,加入ddH2O 洗涤细胞数次,晾干,数码相机拍照,计数克隆。
1.5 主要观察指标 ①CCK-8试剂盒检测不同负压条件干预后各组骨髓间充质干细胞的增殖情况;②RT-PCR检测不同负压条件干预后各组骨髓间充质干细胞中血管内皮生长因子受体mRNA表达;③ELISA分析不同负压条件干预后各组骨髓间充质干细胞培养上清液中血管内皮生长因子水平;④选择一个最佳负压条件和时间(-26.6 kPa,24 h) 用血管内皮生长因子受体抑制剂Axitinib阻断后,CCK-8试剂盒检测骨髓间充质干细胞增殖情况、EDU试剂盒检测 EDU细胞阳性率、结晶紫染色观察细胞集落形成单位。 1.6 统计学分析 使用SPSS 19.0统计软件进行分析。数据以x _ ±s表示,组间比较采用重复测量方差分析,组内比较采用多样本方差分析,P < 0.05为差异有显著性意义。
2 结果 Results
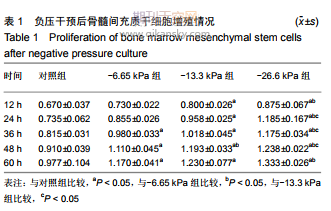
2.1 骨髓间充质干细胞的分离、培养和鉴定结果 原代培养48 h后细胞逐渐贴壁,其他类型的各种杂细胞通过频繁换液逐渐除去,此时贴壁细胞大多呈梭形、多角形,单核细胞状,细胞形态不一,或者为单个或多个细胞的克隆,细胞增殖迅速;培养3-5 d,细胞90%以上融合,融合细胞呈长梭形,细胞集落呈鱼群状生长。传代后4 h可见细胞贴壁呈不规则形并伸出触角;24 h后细胞全部贴壁,可见大部分细胞变为长梭形,具有方向性,部分细胞变为不规则形,杂细胞较少。成骨诱导21 d后茜素红染色可见钙结节红染,见图1。 2.2 不同负压条件干预后各组骨髓间充质干细胞的增殖情况 各组细胞给予负压干预后形态均一,生长旺盛,随负压培养时间延长大部分细胞变成不规则的多角形,细胞细长。随着负压压力梯度升高,镜下观察到细胞生长旺盛、密集,并且胞体丰满;与对照组相比,细胞增殖明显增快,细胞集落增大,细胞间连接紧凑。与对照组相比,低负压条件(-6.65 kPa)、中负压条件(-13.3 kPa)、高负压条件 (-26.6 kPa)对骨髓间充质干细胞增殖均具有促进作用(P < 0.05),见表1和图2。
2.3 不同负压条件干预后各组骨髓间充质干细胞培养上清液中血管内皮生长因子水平 负压干预培养后,-6.65 kPa 组、-13.3 kPa组、-26.6 kPa组血管内皮生长因子分泌水平在5个时间点均高于对照组,且随着负压培养时间延长呈逐渐上升的趋势。在负压培养12 h时,-13.3 kPa组和 -26.6 kPa组血管内皮生长因子分泌量均高于-6.65 kPa组,然而在负压培养24 h时,-13.3 kPa组和-26.6 kPa组血管内皮生长因子分泌量均低于-6.65 kPa组,且在12 h和24 h时, -13.3 kPa组、-26.6 kPa组血管内皮生长因子分泌量差异无显著性意义。负压干预36 h和48 h时,-26.6 kPa组血管内皮生长因子分泌量高于 -6.65 kPa组和-13.3 kPa组(P < 0.05),然而-6.65 kPa组与-13.3 kPa组比较差异无显著性意义(P > 0.05)。负压干预60 h时,-13.3 kPa组、-26.6 kPa 组血管内皮生长因子分泌量均低于-6.65 kPa组(P < 0.05), -26.6 kPa组血管内皮生长因子分泌量显著高于-13.3 kPa 组(P < 0.05),见图3A。
2.4 不同负压条件干预后各组骨髓间充质干细胞中血管内皮生长因子受体mRNA表达 负压干预12 h时,-26.6 kPa 组血管内皮生长因子受体mRNA表达水平高于-6.65 kPa 组、-13.3 kPa组(P < 0.05),-6.65 kPa组、-13.3 kPa组和对照组之间比较差异无显著性意义(P > 0.05)。负压干预 24 h时,-13.3 kPa组、-26.6 kPa组血管内皮生长因子受体 mRNA表达水平均高于-6.65 kPa组(P < 0.05),-26.6 kPa组血 管 内皮 生 长因 子 受体 mRNA 表达 水 平显 著高 于 -13.3 kPa组(P < 0.05)。负压干预36 h时,-26.6 kPa组血管内皮生长因子受体mRNA表达水平显著高于-6.65 kPa 组、-13.3 kPa组和对照组(P < 0.05),对照组和-6.65 kPa 组之间比较差异无显著性意义(P > 0.05)。负压干预48 h时, -13.3 kPa组和-26.6 kPa组血管内皮生长因子受体mRNA 表达水平高于-6.65 kPa组和对照组(P < 0.05),-13.3 kPa 组和-26.6 kPa组之间比较差异无显著性意义(P > 0.05)。负压干预60 h时,-13.3 kPa组血管内皮生长因子受体mRNA 表达水平高于-6.65 kPa组和和-26.6 kPa组,-26.6 kPa组和-6.65 kPa组比较差异无显著性意义(P > 0.05),见图3B。
2.5 骨髓间充质干细胞增殖吸光度值与血管内皮生长因子分泌水平线性关系 根据线性关系分析,负压干预后骨髓间充质干细胞增殖指标吸光度值与血管内皮生长因子分泌水平呈正相关,相关系数为 0.902,P < 0.05,见图 4。
2.6 骨髓间充质干细胞在负压和血管内皮生长因子受体抑制剂 Axitinib 干预后细胞增殖、克隆形成以及 EDU 标记情况 -26.6 kPa 条件下培养 24 h 后,血管内皮生长因子受体抑制剂组吸光度值、EDU 细胞阳性率及集落形成单位个数明显低于负压组(P < 0.05);与对照组比较,血管内皮生长因子受体抑制剂组吸光度值、EDU 细胞阳性率及集落形成单位个数差异无显著性意义(P > 0.05),见图 5,6。
3 讨论 Discussion
负压创面治疗封闭吸引的引流方式,由德国ULM大学创伤外科医院FLEISCHMANN博士在1993年首先报道,1995 年美国食品和药物管理局(FDA)批准其上市,北美及欧洲将其正式应用于临床[16]。美国ARGENTA等[17]运用相同的原理发明了真空辅助闭合装置治疗慢性难愈合创面,之后负压吸引技术被广泛用于临床,其有效性得到了临床医务工作者的认同,目前对负压吸引技术促进创面愈合的机制主要有几个方面:①负压吸引作用于细胞膜,使之扩张、扭曲,细胞自认为就是外界环境刺激,传导损伤的信号给细胞核,通过信息传递,引起细胞分泌多种生长因子,包括表皮生长因子、血管内皮生长因子、转化生长因子β1等从而促进细胞增殖和刺激周围组织产生更多新生血管[18-20];②负压吸引帮助建立创面体液平衡,提供一个湿润的环境及清除坏死组织;③减少创面细菌的数量,抑制细菌生长[21];增加创面的血流,促进白细胞和成纤维细胞进入创面,其中白细胞能抵抗感染产生生长因子,而成纤维细胞能产生胶原,用来填平和修复伤口[22]。
最近,许多学者开始把负压创面治疗促进创面愈合机制的研究逐渐深入至分子水平,例如通过创面负压吸引技术产生的机械牵拉作用可以诱导创面的多种细胞增殖、分化以及分泌多种细胞生长因子[23-24]。有研究表明负压创面治疗可增加轻、中度缺血性足部溃疡患者循环内皮祖细胞的数量,这可能与其上调全身及局部血管内皮生长因子及基质细胞衍生因子1α水平有关[25]。血管内皮生长因子是血管内皮细胞特异性的肝素结合生长因子,可在体内诱导血管新生。血管内皮生长因子家族成员包括血管内皮生长因子A,B,C,D等,其由内皮细胞、角质形成细胞、成纤维细胞、平滑肌细胞、
间充质干细胞、嗜中性粒细胞以及巨噬细胞等细胞分泌。血管内皮生长因子在体外与间充质干细胞表面受体结合可以诱导其向内皮细胞分化、增殖和迁移[26-27],促进创面愈合[28]。基于上述研究,该实验观察负压对于骨髓间充质干细胞增殖能力和分泌血管内皮生长因子水平的影响,并初步探讨负压条件下血管内皮生长因子是否参与骨髓间充质干细胞增殖,为今后负压联合干细胞临床治疗提供一定的实验理论依据。
实验探讨低负压(-6.65 kPa)、中负压(-13.3 kPa)、高负压(-26.6 kPa)3个不同负压条件(12 h 1次,2 h/次)下对骨髓间充质干细胞增殖的影响。结果显示,随着负压增高和培养时间的延长,骨髓间充质干细胞的增殖能力明显增强。研究表明,-16.625 kPa持续性负压吸引能促进骨髓间充质干细胞增殖,并诱导其向成骨表型分化[29]。还有研究报道 -39.9 kPa培养环境可以促进骨髓间充质干细胞增殖,然而 -79.8 kPa培养环境可以抑制骨髓间充质干细胞增殖[30]。 YANG等[31]研究表明负压吸引体外细胞培养技术抑制骨髓间充质干细胞增殖。上述结果与此研究结果存在差异,可能与体外负压装置、培养时间和设定的培养条件有关。研究表明,相对于持续性负压培养,间断性负压培养可以促进骨髓间充质干细胞增殖,其机制可能是因为骨髓间充质干细胞长期处于缺氧状态对细胞存在一定损伤。此研究发现,负压培养状态下骨髓间充质干细胞上清中血管内皮生长因子水平也随着负压增加和培养时间的延长逐渐增加。负压体外培养可以促进骨髓间充质干细胞分泌血管内皮生长因子诱导分化成骨[32]。研究发现,特定负压条件可以上调骨髓间充质干细胞自分泌血管内皮生长因子水平,促进其向内皮细胞分化[32]。上述负压促进骨髓间充质干细胞分泌血管内皮生长因子水平和此研究结果一致。根据线性相关分析各个时间点细胞增殖检测指标吸光度值和血管内皮生长因子表达水平呈正相关。为了进一步探究血管内皮生长因子与骨髓间充质干细胞增殖的关系,用血管内皮生长因子受体特异性抑制剂联合最佳负压模式共同干预骨髓间充质干细胞。结果显示,血管内皮生长因子受体抑制剂组细胞增殖吸光度值和EDU阳性细胞率明显低于负压组。在适度的负压环境下细胞增殖明显增强,由于作者所在实验室的负压装置最大可调控负压为 -26.6 kPa,故实验分组设定最大负压强度为-26.6 kPa。
综上所述,随着负压强度增大,骨髓间充质干细胞可能通过上调血管内皮生长因子分泌促进其增殖。关于负压如何上调骨髓间充质干细胞分泌血管内皮生长因子水平,以及血管内皮生长因子如何介导骨髓间充质干细胞增殖的具体机制有待研究。
澹版槑:鈶犳枃鐚潵鑷煡缃戙€佺淮鏅€佷竾鏂圭瓑妫€绱㈡暟鎹簱锛岃鏄庢湰鏂囩尞宸茬粡鍙戣〃瑙佸垔锛屾伃鍠滀綔鑰�.鈶″鏋滄偍鏄綔鑰呬笖涓嶆兂鏈钩鍙板睍绀烘枃鐚俊鎭�,鍙仈绯�瀛︽湳椤鹃棶浜堜互鍒犻櫎.
SCISSCIAHCI