0
留言稍后联系!

发布时间:2021-09-08所属分类:医学论文浏览:1次
摘 要: 【摘要】骨折复位内固定术是骨科的常规手术,内固定作为该手术的关键步骤之一,目的是维持骨折断端的复位。现阶段临床上使用的接骨板和螺钉系统大多数采用金属材料通过传统工艺制备而成,因其缺乏个性化外形且不具备降解性能,常常难以匹配特殊形态的骨折部

【摘要】骨折复位内固定术是骨科的常规手术,内固定作为该手术的关键步骤之一,目的是维持骨折断端的复位。现阶段临床上使用的接骨板和螺钉系统大多数采用金属材料通过传统工艺制备而成,因其缺乏个性化外形且不具备降解性能,常常难以匹配特殊形态的骨折部位且需要二次手术取出。可降解材料结合增材制造技术有望解决以上问题,其可赋予接骨板个性化外形和降解性能,达到更好的治疗效果。但目前可降解个性化接骨板的制备和临床试验流程在国内外均缺乏统一认识和标准。因此,本共识专家组经过多轮讨论,以有机/无机复合材料接骨板为例,从可降解个性化接骨板的“增材制造流程”和“临床试验流程”两方面出发形成本共识,为国内外各中心可降解个性化接骨板的制备和临床试验提供参考。
【关键词】骨折内固定术;接骨板;可降解;个性化;增材制造;临床试验
骨折复位内固定术是骨科的常规手术[1⁃3],内固定作为该手术的关键步骤之一,目的是维持骨折断端的复位以促进骨折愈合[4⁃5]。现阶段临床上使用的接骨板和螺钉系统大多为金属材质,如不锈钢[6]、钛及钛合金[7]以及镁基金属[8],均存在不同的缺点。传统的不锈钢及钛合金接骨板不可降解且缺乏个性化外形,常常难以匹配特殊形态的骨折部位且需要二次手术取出。近年来虽有镁基接骨螺钉进入临床试验[9⁃11],具备良好的力学性能和降解性能,但仍存在降解速率过快、降解产物伴随氢气释放等一系列安全性问题[12]。增材制造技术因其可赋予植入物个性化外形而广泛应用于医疗领域[13⁃14],生物材料在骨科临床的应用也日益广泛[15⁃17]。增材制造技术结合可降解生物材料制备的可降解个性化接骨板有望解决目前传统接骨板的不足。由于可降解个性化接骨板大部分尚处于临床试验阶段,研究者对于其增材制造制备和临床试验流程在国内外均缺乏统一认识和标准。因此,国家重点研发计划《可降解个性化骨科植入物增材制造关键技术与装备的研究》项目组依托中国装备协会医用增材制造专家委员会,组织相关领域专家,针对“可降解个性化接骨板的增材制造及临床试验流程”展开深入讨论,将整个流程分为可降解个性化接骨板的“增材制造流程”和“临床试验流程”两个部分,整理完成共识。本共识以可降解有机/无机复合材料接骨板为例进行阐述,旨在为国内外各单位可降解个性化接骨板的研发和临床试验提供参考和指导。
一、可降解个性化接骨板的增材制造流程
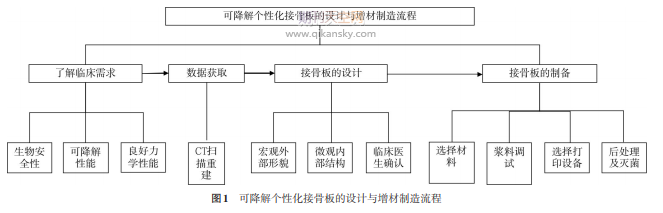
不同类型的可降解个性化接骨板虽在材料选择、制备工艺和应用部位方面有所不同,但其在增材制造设计和制备环节的流程基本是一致的[18⁃19]。其设计制备流程可概括为4个环节,即了解临床需求、数据获取、接骨板的设计、接骨板的制备,其具体流程如图1所示。
(一)了解临床需求
应对临床上形态各异的骨折断端,理想的接骨板应达到以下要求:①具有良好的生物相容性和降解性能;②具备与骨折部位匹配的个性化外形;③具有良好的力学性能;④达到无菌标准。
(二)数据获取
建议对骨折部位行CT扫描,获取骨折部位及其周围骨骼的原始数据,通过三维重建获取骨折部位的形态参数。对于移位严重的复杂骨折,建议同时行健侧CT扫描以帮助患侧建模。
(三)接骨板的设计
使用专业的建模软件对获取的CT原始数据进行处理,三维重建后将移位的骨折断端拼接复位。基于复位后的骨骼表面形态,设计覆盖骨折线且贴合骨面的接骨板,接骨板的厚度依据降解材料的特性而定,接骨板表面应光滑,边缘部分圆弧过渡,无尖角。然后根据骨折线的位置、骨折线周围血管神经等解剖结构,综合考虑生物力学等因素设计钉孔数目和钉道方向。钉孔的设计应考虑使用的可降解螺钉的品牌和规格参数。模型建立后,通过有限元分析方法检验设计的模型能否满足骨折固定的力学要求。
接骨板的设计过程必须有临床医生全程参与,保证术前虚拟设计和实际手术植入位置的一致性以及术中操作的可行性。个性化接骨板设计完成后,最终由临床医生审核确认后签字通过。
(四)接骨板的制备
1.选择材料
用于制备可降解个性化接骨板的原材料应满足以下要求[20]:①具有良好的生物相容性、生物可降解性和成骨诱导能力;②材料本身适用于增材制造要求;③材料增材制造成形后其力学强度满足接骨板的要求。本共识以可降解聚乳酸/磷灰石复合材料为例,其具备良好的生物相容性、力学性能和降解性能[21⁃22],满足制备可降解个性化接骨板的要求。
2.浆料调试
合适的浆料是增材制造技术制造接骨板的关键,以聚乳酸为基体的复合材料需要具备足够的力学性能,以及降解后稳定的pH值。为满足要求,通过引入质量分数为15%的羟基磷灰石作为增强相,此时复合材料具有最佳的力学性能。同时,羟基磷灰石的引入能够有效缓解聚乳酸降解酸性的问题。为了配合打印,配置成打印浆料。浆料中的溶剂快速挥发后,复合材料固化成型,强度提高,具备良好的支撑效果。
3.选择打印设备
选用常温挤出成形方式的增材制造设备。先将3D模型用软件切片生成代码,在增材制造设备上选取加工代码打印(打印中使用0.10~0.25mm的层高,并使用较低的喷头运动速度,以尽量减少溶剂挥发可能在成型件中产生的气泡),逐层打印完成。
4.后处理
打印完成后将成形件放置于50℃恒温箱内静置5h以上,待其完全干燥固化后取出。
5.材料灭菌要求
接骨板需达到无菌标准。可采用环氧乙烷或60Co射线灭菌。环氧乙烷是一种广谱灭菌剂,可在常温下杀灭各种微生物,目前医疗器械广泛采用环氧乙烷来灭菌。但环氧乙烷是一种有毒的致癌物质,灭菌后需要检测其残留量,结果应不大于10mg/cm2[23]。60Co射线法灭菌剂量应采用15kGy或25kGy,具体使用方法参考《消毒与灭菌效果的评价方法与标准》(GB15981⁃1995)[24]。
二、可降解个性化接骨板临床试验流程
增材制造的可降解个性化接骨板临床试验流程可概括为4个部分,依次为临床前生物安全性评价和性能检测、临床试验伦理申请、临床试验保险购买和临床试验开展,其具体流程如图2所示。
(一)可降解个性化接骨板的生物安全性评价与性能检测
增材制造的可降解个性化接骨板在应用于临床前应经过严格的检测流程。检测环节主要包括生物安全性评价和临床使用产品的性能检验。
1.生物安全性评价
由于增材制造过程和工艺对材料本身性能可能造成影响,打印过程中可能引起材料的变性和加入必要的化学成形试剂,最终可能会产生新的生物学风险,因此有必要对增材制造的产品进行生物安全性评价。按照《医疗器械生物学评价第1部分:风险管理过程中的评价与试验》(GB/T16886.1⁃2011)[25]中的系统方法框图及《国家食品药品监督管理局关于印发医疗器械生物学评价和审查指南的通知》(国食药监械〔2007〕345号)中的审查要点进行风险评价和必要的生物相容性试验。建议检测内容包括但不限于:细胞毒性试验、致敏试验、皮内反应试验、遗传毒性试验、急性全身毒性试验、亚慢性全身毒性试验、植入试验、热原试验等[25⁃26]。生物安全性评价需由具备检测资质的机构进行并出具相应的生物安全性评价报告。生物安全性评价是进入临床试验前伦理审查的必要条件。
2.性能检测
可降解个性化接骨板进入临床前需进行性能检测,应按照《医疗器械产品技术要求编写指导原则》编写可降解个性化接骨板的产品技术要求。产品技术要求主要包括医疗器械成品的性能指标和检测方法,其中性能指标是指可进行客观判定的成品的功能性、安全性指标以及与质量控制相关的其他指标。产品技术要求中应明确规格型号及其划分的说明、产品性能指标及试验方法、产品描述一般信息(原材料、组成成分、结构等)、产品灭菌方式及货架有效期。产品技术要求中的指标应针对终产品制定,且性能指标不可低于产品适用的强制性国家标准和/或强制性行业标准,检验方法应当优先考虑采用公认的或已颁布的标准检验方法,包括推荐性标准,并注明相应标准的编号和年代号[26]。
相关知识推荐:骨科好发的低分SCI杂志
按照产品技术要求对每个批次的产品进行抽样检测。检测可由具有资质的检测机构完成,并出具相应的检测报告。建议《产品技术要求》应主要包括但不限于以下几个方面:①材料成分、降解成分,检测接骨板及其降解产物的化学成分和组成,产品材料应符合相关标准的规定,如平均分子量、分子量分布、单体残留、催化剂残留、溶剂残留、含水量、重金属含量、终产品中其他有害小分子物质的残留量要求等[27];②产品表面质量、尺寸及产品尺寸精度可参照YY0017⁃2016《骨接合物金属接骨板》[28];③检测接骨板的表面结构,可采用体视学方法、扫描电子显微镜(SEM)等方法观察接骨板的表面特征;④力学性能,需对可降解个性化接骨板样件进行动静态力学性能测试,如刚度、抗压强度、拉伸强度及弯曲强度等;⑤降解速率和降解性能测试,检测增材制造的接骨板的降解速率以及降解引起周围环境pH值的变化规律,同时检测降解过程中接骨板的力学性能随降解时间的变化规律[29];⑥细菌内毒素检验,增材制造过程中可能引入细菌,灭菌后接骨板内会有细菌碎片的残留,因此接骨板灭菌后需要针对细菌内毒素的残留进行检测;⑦无菌检测,接骨板需达到无菌标准,可依据GB/T14233.2⁃2005和2020版《药典》进行无菌检查[30⁃31];⑧环氧乙烷残留量检测,如使用环氧乙烷进行灭菌,需依据规定的方法进行残留量检测[23]。以上所有检测合格并出具检测报告后,该批次的产品方可进入临床使用。
(二)临床试验伦理申请
1.确定临床试验类型
任何新研发的植入物在开展临床试验前,都必须通过医院伦理委员会的审查批准。首先需要明确的是研发植入物是适用于研究者(医师/科研人员)发起的临床试验(investigator⁃initiatedclinicaltrial,IIT)还是医药企业发起的临床试验(industry⁃spon⁃soredclinicaltrial,IST),二者的申请流程和适用的管理办法不同。如果是研究者发起的临床试验,植入物是以科学研究为目的,适用的法规是《医疗卫生机构开展临床研究项目管理办法》,执行相应科研部门的医学伦理程序[32];而医药企业发起的临床试验,适用的法规是《药物临床试验质量管理规范》和《中华人民共和国药品管理法》;如植入物以上市为目的,则要按照相应的临床药理中心的流程进行。
2.制定临床试验方案
在临床试验开始前,应撰写详细的临床试验方案、知情同意书、研究病历等文件,并由专家组进行方案的论证。项目临床试验方案包括但不限于:入组/排除标准、样本量估算、治疗方案及试验流程、疗效评定标准及安全性评估、不良事件记录与处理、受试者费用说明和隐私保护等内容。样本量估算需要确定是否设置对照组、计算方法以及脱落因素的考虑等。受试者费用说明需明确免费与收费项目、补助项目、受试者损害的医疗处理和赔偿等费用来源。知情同意书主要面向受试者,重点说明受试者承担的风险与收益,自由退出的权利,有关费用和补偿,个人信息保密等问题。研究病历主要详细记录受试者参加临床试验期间的全部资料与数据。
3.伦理审查
伦理审查由所在医院伦理委员会进行,内容主要包括试验方案的设计与实施、试验的风险与收益、受试者的招募、知情同意书告知的信息、知情同意的过程、受试者的医疗保护、隐私和保密等内容。伦理委员会充分讨论后,作出批准、不批准、修改后批准、修改后再审、暂停或者终止研究的决定。研究者获得批准后方可开展临床试验。
(三)临床试验保险购买
1.确定是否购买临床试验保险
《药物临床试验质量管理规范》提出了“申办方应对参加临床试验的受试者提供保险”的建议,申办方一般是指赔付责任主体即研究者,被保险人也多为申办方。对于研究者发起的科研临床试验而言,建议购买临床试验保险。
2.临床试验保险购买与注意事项
研究者需在有临床试验保险从业资质的保险公司购买保险。双方首先签署“保密协议”,保障信息安全和自身利益,保险方案需要根据临床试验内容确定“免赔额”、“每人赔偿限额”、“累计赔偿限额”、“保险年限”和“特别约定”等附加条款内容。特别需要注意的是可与保险公司协商制定“相关性赔付比例”,根据与临床试验的相关性制定赔付比例。确定方案与报价后对保险公司出具的投保单内容进行确认并支付保单,在保险生效期内进行临床试验。
(四)临床试验的开展
临床试验开展分为受试者筛选、手术操作流程、病人随访、中止临床试验标准和原因记录、临床试验不良事件处理五个方面,下文针对桡骨远端骨折和锁骨骨折病人展开的临床试验为例进行说明。
1.受试者筛选
受试者筛选时需遵循以下步骤:①院前完成常规检查;②评估病人是否具有手术适应证及禁忌证;③若病人拟进行手术,则入院进行入排筛选,病人年龄在18~85周岁发生桡骨远端等特殊形态非负重部位的骨折,并愿意且能够签署知情同意书即可入组;若病人拒绝临床试验或合并对临床试验影响较大的其他疾病或情况,则被排除;④签署知情同意书,向病人详细解释本临床试验过程,如研究内容、研究过程、受试者的获益和风险等,病人在充分知情基础上签署知情同意书;⑤完善试验相关实验室检查和临床检查,推荐实验室检查包括血常规、肝功能、肾功能、尿常规、红细胞沉降率(ESR)、C反应蛋白(CRP)、降钙素原(PCT),绝经前女性还需进行尿妊娠试验(尿HCG);临床检查包括12导联心电图、骨折部位X线检查、骨折部位CT+三维重建;⑥完善功能评估,以桡骨远端骨折为例,建议行Gartland⁃Wer⁃ley腕关节功能评分和疼痛视觉模拟量表(VAS)评分;⑦完善研究病历填写,研究病历内容建议包括病人基本信息、生命体征、疾病信息、既往史、合并用药、各项检查报告和评分表等。
2.手术操作流程
(1)桡骨远端骨折①病人麻醉稳妥后,取平卧位,上臂外展,使用上肢止血带,手术区域常规消毒。②沿左桡侧腕屈肌于掌长肌腱间作一8~10cm长的切口,远端0.5cm作一折尺形切口。切开皮肤及皮下组织,向下钝性分离,向内可感桡动脉搏动,切口内侧检桡侧腕屈肌腱,沿桡侧腕屈肌于掌长肌腱间隙向下钝性分离;切断旋方肌并标记,向两侧分离旋前方肌,直至桡骨骨折端,可见桡骨粉碎性骨折,骨折端见淤血及软组织。③清除骨折端软组织及淤血,复位后使用克氏针临时固定骨折,将个性化接骨板置于桡骨掌侧合适位置,按照术前规划的钉孔和可吸收螺钉依次钻孔、测深、攻丝、拧螺钉。④“C”型臂X线机透视见骨折对位良好,骨折对合良好,内固定可靠。⑤伤口内冲洗枪反复清洗伤口,止血,清点纱布、针、线、器械无误,逐层缝合各层伤口。⑥无菌敷料适度加压包扎伤口。
(2)锁骨骨折①颈丛麻醉满意后,取仰卧位,抬高患侧肩部,常规消毒铺巾。②沿锁骨走形纵行切开皮肤、筋膜组织,显露骨折断端,见锁骨骨折断端侧方移位,清除周围淤血及嵌顿组织,扣钳辅助复位,使用个性化锁骨接骨板固定,按照术前规划的钉孔和可吸收接骨螺钉依次钻孔、测深、攻丝、拧螺钉;术中透视见内固定物位置良好,骨折对线良好。③彻底止血,以双氧水、活力碘、生理盐水冲洗切口,逐层缝合切口。④无菌敷料适度加压包扎伤口。
(3)手术操作注意事项①注意可吸收接骨螺钉的选择,在接骨板设计时应考虑可吸收螺钉的品牌及规格参数;②注意接骨板与骨折部位骨面的匹配,注意螺钉植入方向和松紧程度;③彻底冲洗,防止材料碎片残留。
3.受试者随访
病人术后即刻、术后6周、3个月、6个月、12个月随访时按计划复查临床试验方案要求的相关实验室检查和影像学检查,并填写相应功能评分表和研究病历。复查X线检查对骨折愈合情况进行动态观察。以桡骨远端骨折为例,可根据以下指标判断骨折愈合情况[33]:①腕关节局部有无压痛及纵向叩击痛;②局部有无异常活动;③X线片显示骨折线是否模糊,有无连续性骨痂通过骨折线;④腕关节功能评分,如VAS评分和Gartland⁃Werley腕关节评分。
需要注意的是,临床试验期间受试者的功能评分和影像学资料评估应采用双盲法,由3名具有5年以上评估资历的临床医师进行评估。当随访满12个月且受试者恢复良好时,即可完成临床试验随访过程。当受试者完成临床试验随访后,若出现与临床试验可能相关的疾病或并发症,仍可联系医师进行随访治疗,以解除受试者的病痛和进一步观察该临床试验可能存在的远期并发症。
4.中止临床试验标准和原因记录
如中止临床试验需遵循以下标准:①受试者主观退出临床试验;②试验期间发生不良事件而导致试验中止;③受试者失访或出现影响试验数据评定的情况则中止临床试验。临床试验结束后需记录受试者结束研究的日期,若提前退出,记录其退出的原因。
5.临床试验不良事件处理
临床试验期间发生的任何不良医疗事件,无论与试验植入物是否有因果关系,均判定为不良事件。受试者出现不良事件时,研究者应对受试者进行积极干预,直至受试者病情得到控制。任何不良事件都应如实详细记录,包括不良事件的名称、发生和终止的时间、严重程度、与已知事件的关系、采取的措施和转归,最后进行统计学分析。当判断该不良事件属于严重不良事件时,无论与试验植入物有无关系,必须立即采取适当的治疗措施,同时在获悉后24h内报告医院伦理委员会。不良事件发生期间根据保险条款规定进行相应赔偿。
三、结语
增材制造的可降解个性化接骨板由于具备可定制的个性化外形、良好的生物安全性和降解性能,在骨折内固定术中具有巨大优势,未来有望在临床中得到广泛应用。本共识以有机/无机复合材料接骨板为例,着重讨论其设计制造和临床试验的规范化流程,为可降解个性化接骨板的制备和临床试验提供参考。今后仍需不断规范可降解个性化接骨板增材制造设计、制备和临床试验流程中的原则和标准,以期实现可降解个性化接骨板增材制造及临床试验流程的有效性和统一化,加速其临床转化进程。——论文作者:齐大虎1△李慈2△朱皓1△董献振3△苏瑾4△景明5△张焙智3△胡斌6△石志良7△田静静8△戴红莲3*周钢4*方忠1*罗政强1*胡懿郃9*张培训2*赵宇8*肖骏1*
婢圭増妲�:閳剁姵鏋冮悮顔芥降閼奉亞鐓$純鎴欌偓浣烘樊閺咁喓鈧椒绔鹃弬鍦搼濡偓缁便垺鏆熼幑顔肩氨閿涘矁顕╅弰搴㈡拱閺傚洨灏炲鑼病閸欐垼銆冪憴浣稿灁閿涘本浼冮崰婊€缍旈懓锟�.閳垛€愁洤閺嬫粍鍋嶉弰顖欑稊閼板懍绗栨稉宥嗗厒閺堫剙閽╅崣鏉跨潔缁€鐑樻瀮閻氼喕淇婇幁锟�,閸欘垵浠堢化锟�鐎涳附婀虫い楣冩6娴滃牅浜掗崚鐘绘珟.

SCISSCIAHCI