0
留言稍后联系!

发布时间:2022-04-09所属分类:农业论文浏览:1489次
摘 要: 摘 要: 目的 研究螺杆挤压对马铃薯淀粉消化特性的影响。方法 马铃薯淀粉经过螺杆挤压后(过程中淀粉未膨化), 采用酶重量法测定挤压后抗性淀粉的含量变化情况, 并通过模拟体外消化和动物实验评价挤压后淀粉的消化性能和餐后血糖上升速率。结果 螺杆挤压后马铃薯淀粉中抗

摘 要: 目的 研究螺杆挤压对马铃薯淀粉消化特性的影响。方法 马铃薯淀粉经过螺杆挤压后(过程中淀粉未膨化), 采用酶重量法测定挤压后抗性淀粉的含量变化情况, 并通过模拟体外消化和动物实验评价挤压后淀粉的消化性能和餐后血糖上升速率。结果 螺杆挤压后马铃薯淀粉中抗性淀粉的含量增加了 1.08%, 酶解时间为 0~1.5 h 时, 马铃薯淀粉快速消化淀粉的含量减少, 酶解时间为 1.5~6.5 h 时, 抗性淀粉和慢消化淀粉的含量增加。挤压后的马铃薯淀粉在一定程度上可以降低小鼠的餐后血糖指数。结论 螺杆挤压技术可以提高抗性淀粉和慢消化淀粉的含量, 减缓餐后血糖上升速率, 为马铃薯食品的深度开发提供一定的参考。
关键词: 螺杆挤压; 马铃薯淀粉; 动物实验; 血糖指数; 抗性淀粉; 缓慢消化淀粉
1 引 言
马铃薯(Solanum tuberosum)是一年生草本植物, 公元前 8000 到 5000 年的南美秘鲁南部地区最早出现人工栽培, 并于 17 世纪左右传入中国。由于马铃薯的栽培要求很低且产量和其他主粮相比较高, 所以很快在内蒙、河北、山西、陕西北部普及, 成为当地人们的主要食品之一, 对维持中国人口的迅速增加起到了重要作用。马铃薯含有丰富的赖氨酸和色氨酸, 其所含的蛋白质与动物蛋白接近, 这是其他主粮所无法比拟的。另外, 马铃薯几乎不含脂肪, 其钾含量是蔬菜中最高的, 因此适合水肿型肥胖者的食用[1]。和其他国家相比, 我国的耕地面积和人口比例严重偏小, 保障粮食安全成为中国现代化过程一个较为关键的问题。介于马铃薯的产量高、可种植面积广、气候和土壤要求低等特点, 2010 年两会上全国人大常委会委员郭凤莲的提案揭开了我国马铃薯主粮化战略的序幕。此后, 农业部于 2015 年把马铃薯主粮化工作列入重要议程。该战略实施不仅有助于种植业结构调整以实现农业可持续发展, 保障我国粮食安全, 而且可以满足居民膳食营养结构的转型和升级[2]。从农业, 特别是粮食生产和加工层面, 实施侧向改革。在马铃薯主粮化战略实施过程中存在以下障碍: (1)传统饮食习惯。马铃薯仅在少数地区被当作主粮食用, 在国内绝大部分区域, 马铃薯主要用作蔬菜食用[3]; (2)餐后血糖上升过快。和其他传统主粮相比, 马铃薯的升糖指数高达 90, 远高于大米、小麦粉和玉米的值(~60)[4], 长期大量摄入马铃薯还会带来糖尿病[5]、高血压[6]等副作用。虽然现在有学者注意到此问题, 并试图通过微波技术[7]、热压技术[8]、烹饪方式[9]等解决马铃薯升糖指数过高的问题, 但效果甚微。
研究证明抗性淀粉(resistant starch, RS)和慢消化淀粉 (slowly digestible starch, SDS)能很好的解决餐后血糖快速上升问题。一般的化学方法虽然可以大大提高淀粉中 RS 和 SDS 的占比, 但处理后的淀粉存在化学试剂残留、产品成分难控制等问题故大多用于工业材料的制造。为了规避化学方法的缺点, 运用有效的物理方法加工淀粉以降低淀粉产品的血糖指数成为当务之急。挤压技术能规避化学方法的缺点, 通过高温高压处理淀粉提以高变性淀粉含量是目前较为常见的手段[8,10], 和其他传统的食品生产工艺相比, 有生产工艺简单、能耗低、三废排放少等优点[11], 还能够满足食品对于安全性的要求。因此, 该技术在食品、材料、工程、医药、生物化学、农学、环境等领域得到广泛应用。从文献检索得知, 目前国内利用螺杆挤压技术改变淀粉中 RS 和 SDS 的含量研究仅针对玉米[12]和大米[13] 体系, 国外研究者的研究对象则较广, 如小麦粉[14]、高粱和大麦的混合物[15]、全谷物燕麦[16]等。利用挤压技术改变马铃薯的抗性淀粉含量结果存在争议[17]。使用螺杆挤压技术对马铃薯淀粉进行处理, 在高温高压和一定湿度(0%~ 20%)的条件下, 产品外观艳丽, 柔韧性和耐咀嚼性好, 可以克服常规加工中存在的低粘弹、不易聚团等的问题。在螺杆挤压的过程中摒弃了传统挤压技术中的膨化工序, 马铃薯淀粉颗粒在高温、高压、高剪切的作用下发生降解、聚集、交联等物理化学变, 淀粉颗粒密度变大, RS 和 SDS 成分增加。由于 RS 和 SDS 在马铃薯淀粉中占比的增加, 在消化的过程中能够达到持续释放还原糖, 故螺杆挤压后的马铃薯淀粉产品可作为十分安全的食品原材料应用于食品制造业, 并能够明显改善马铃薯淀粉食用后血糖上升过快的问题。本研究对螺杆挤压与马铃薯淀粉消化性及血糖指数间的关系进行研究, 以期促进了马铃薯种植业的发展, 推动马铃薯主粮化进程。
2 材料与方法
2.1 材料与试剂
马铃薯淀粉由浙江迈峰宠物用品有限公司提供; ICR 小白鼠购于杭州师范大学实验动物中心。
耐高温 α-淀粉酶(40000 U/g)、淀粉葡萄糖苷酶 (100000 U/g) (江苏锐阳生物技术有限公司); α-猪胰蛋白酶(50 U/mg, 美国 Sigma 公司); 3,5-二硝基水杨酸(98%, 阿拉丁试剂(上海)有限公司); 葡萄糖、酒石酸钾钠、苯酚、无水亚硫酸钠、柠檬酸钠、柠檬酸、氢氧化钠(分析纯, 国药集团化学试剂有限公司)。
2.2 仪器与设备
UV-2600 紫外分光光度计(日本岛津公司); SHZ82A 水浴恒温振荡器(天津广丰科技有限公司); FE20pH 计(美国 Mettlertoledo 公司); ROTINA 380 R 台式高速离心(德国 Hettice 公司); SSE 100 单螺杆膨化机(济南鼎润机械设备有限公司); UltraEasy 型血糖仪(强生医疗器材有限公司)。
2.3 实验方法
2.3.1 螺杆挤压工艺参数
螺杆转速: 8.5 r/s; 喂料速度: 2.9 r/s; 物料含水量: 马铃薯淀粉含水量要达到 10%~15%; 螺杆挤压机温度设定: 一区: 95 ℃, 二区 110 ℃, 三区 125 ℃, 四区 75 ℃。
2.3.2 螺杆挤压产品难消化成分的测定
采用美国分析化学家学会(Association of Official Analytical Chemists, AOAC)[10]推荐的酶—重量法稍加修改测定螺杆挤压后马铃薯淀粉中抗性淀粉的含量。测定方法如下:
取适量过 100 目筛子后的螺杆挤压样品, 加蒸馏水并用玻璃棒搅拌均匀, 柠檬酸调节 pH 至 6.0。加入耐高温 α-淀粉酶(500 U/g 螺杆挤压过筛样品), 90 ℃下水浴加热 30 min, 并不断搅拌。待混合溶液冷却至室温, 用柠檬酸调节 pH 至 4.5, 加入淀粉葡萄糖苷酶(5000 U/g 螺杆挤压过筛样品), 在 60 ℃下水浴振荡 24 h。60 ℃水浴过后, 待混合溶液冷却至室温, 反复离心(3000 r/min, 20 min), 取沉淀。将沉淀溶于 2 mol/L NaOH 溶液充分溶解, 用 HCl 溶液调节 pH 至 6.5, 加入耐高温 α-淀粉酶 (500 U/g 螺杆挤压过筛样品), 在 90 ℃下水浴加热 30 min, 不断搅拌。冷却至室温, 用柠檬酸调节 pH 至 4.5, 加入淀粉葡萄糖苷酶(5000 U/g 螺杆挤压过筛样品), 在 60 ℃下水域振荡反应 1 h。冷却至室温后, 蒸馏水水洗后 3000 r/min 反复离心, 取上清液定容至 100 mL。采用 3,5-二硝基水杨酸(DNS)法测定还原糖。抗性淀粉的含量依据公式(1) [18,19]计算得出:
RS(%)=100G(%)×0.9 (1)
式中, RS—抗性淀粉的含量; G—还原糖的含量; 0.9—还原糖换算成淀粉的换算系数。
2.3.3 螺杆挤压产品消化性能的测定
(1) 葡萄糖标准曲线的制作
准确称取 80 ℃烘至恒重的分析纯葡萄糖 100 mg, 加蒸馏水溶解定容至 100 mL, 放置于 4 ℃冰箱中保存备用。按照 0、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8 mg/mL 的梯度取样配置溶液。取出的样品加入 1 倍的 DNS 试剂充分混匀, 沸水浴 5 min 再加 8 倍的水于 540 nm 下测吸光度[20]。以吸光值为纵坐标, 葡萄糖浓度为横坐标作图, 制作标准曲线。
(2) 样品消化性能的测定
准确称取 0.6 g 杆挤压后的马铃薯淀粉产品, 溶于 70 mL 去离子水中, 加入 α-猪胰淀粉酶(10000 U/g 螺杆挤压后的马铃薯淀粉)摇匀。置于 37 ℃的恒温震荡水浴锅中并且按照 0、0.5、1.5、2.5、3.5、4.5、5.5、6.5 h 的时间间隔取样。取出的样品经沸水浴 5 min 灭酶处理后以 5000 r/min 离心 5 min。取上清液稀释 10 倍后, 取一定量稀释后的溶液加 1 倍的 DNS 试剂沸水浴 5 min, 再加 8 倍的蒸馏水于 540 nm 下测吸光度[21,22](整个过程以 56 ℃糊化后的马铃薯淀粉为对照)。
2.3.4 小鼠摄入马铃薯淀粉后血糖浓度的变化
(1) 小鼠的分组与饲养
选用 18~22 g 的 ICR 雄性小白鼠, 小白鼠要事先在实验室饲养 3 d 以适应环境, 饲养室的温度保持在 22~25 ℃, 相对湿度保持在 50%左右, 并且通风状况良好[23]。饲养小白鼠的笼具应该事先用酒精消毒处理, 并且鼠笼里应该有干净干燥的木屑。
实验用小鼠随机分为 A、B 2 组, 每组各 6 只并分别编号。小白鼠在适应环境期间正常喂食、喂水, 待小白鼠适应饲养室的环境后, 先对小白鼠进行时长为 1 d 断食不断水处理, 然后分别给小白鼠喂食, A 组小白鼠喂食糊化后的淀粉, B 组下白鼠喂食螺杆挤压后的马铃薯淀粉。
(2) 小白鼠饲料的配置方法
称取一定量的马铃薯淀粉按照 1:20 的比例加水 56 ℃糊化, 待糊化完全后, 将糊化后的马铃薯淀粉平铺于蒸发皿中, 50 ℃于真空干燥箱中干燥至恒重。将糊化后烘干的马铃薯淀粉用中草药粉碎机粉碎过 100 目筛。过筛后的淀粉加入 2 倍的温开水充分搅拌。
螺杆挤压处理后的马铃薯淀粉用中草药粉碎机粉碎过 100 目筛, 过筛后的马铃薯淀粉加入 2 倍的温开水充分搅拌。
(3) 实验方法及测定指标
实验周期为 10 d, 对断食不断水处理后的 B 组小白鼠喂食螺杆挤压后的淀粉, A 组小鼠喂糊化后的马铃薯淀粉样品。早上 10:00~11:00 喂食 1 h, 晚上 20:00~22:00 喂食 2 h。在喂食时间段外对小白鼠进行断食不断水处理, 小白鼠的饮水采用新鲜的凉白开, 加 0.9%的盐。
相关知识推荐:安徽农业系列职称评审论文要求
实验以小白鼠的血糖为测定指标, 每天测定 1 次。血糖测定选用 ONETOUCH Ultra 稳豪型血糖试纸和 OneTouch Ultraeasy 血糖仪。喂食后 1 h 对小鼠进行采血处理。小白鼠取血之前, 先对小鼠尾部用碘酒消毒, 采血针(为了避免小鼠出现交叉感染采血针都为一次性使用)对消毒部位进行采血, 血滴进入试纸顶部边缘的窄道中, 等待 5 s 后读取小白鼠的血糖, 再次用碘酒对小鼠采血部位进行消毒止血。
3 结果与分析
3.1 螺杆挤压后马铃薯淀粉中抗性淀粉(RS)含量的测定
借鉴抗性淀粉测量方法专利[10], 测出经螺杆挤压后的马铃薯淀粉中抗性淀粉的含量由图 1 可知, 未经螺杆挤压处理的马铃薯淀粉中 RS 产率为 0.759%, 而经螺杆挤压处理后马铃薯淀粉的 RS 产率显著增加, 达到了 1.84%。经螺杆挤压处理后的马铃薯淀粉中 RS含量增加 1.08%, 从占比上来看马铃薯淀粉中 RS 含量的提高十分有限, 但是对于大批量的马铃薯淀粉这种单纯的物理加工方式所产生的效果已经十分可观。马铃薯淀粉在螺杆挤压过程中仅仅经历挤压过程中的高温、高压、高剪切等多重作用, 而没有经过传统挤压技术的膨化工序, 故淀粉颗粒发生了部分降解、聚集、交联等物理化学变化, 在这个过程中这不仅仅形成了能够降低升糖指数的 RS, 而且还产生了很大一部分的 SDS。RS 和 SDS 的存在导致马铃薯淀粉吸水性降低, 酶解速度减弱。
3.2 螺杆挤压产品消化性能的测定
3.2.1 葡萄糖标准曲线按照 2.3.3 的(1)中葡萄糖标准曲线的制作方法所得的标准曲线如图 2 所示。
3.2.2 挤压产品消化性能测定
在相同条件下对马铃薯淀粉(未经过糊化处理)和螺杆挤压后的马铃薯淀粉消化特性进行了研究(图 3), 按照 2.3.3的(2)中的方法测定了马铃薯淀粉(未经过糊化处理)和螺杆挤压后的马铃薯淀粉在不同时间下的还原糖含量。
一般情况下, 定义在 1.5 h 前可以释放还原糖的淀粉称之为快速消化淀粉(RSD), 1.5 h 以后释放还原糖的淀粉都可以认为是缓慢消化淀粉(SDS)和难消化淀粉(RS)[24]。在螺杆挤压的过程中, 经过高温、高压、高剪切力的作用, 马铃薯淀粉分子降解变成小分子的单糖和多糖等, 这些小图 3 样品的消化曲线(n=3) Fig. 3 Digestion curve of the sample (n=3) 分子物质在高温高压的作用下又重新发生了聚集、交联等物理化学变化, 组成新的物质。由图 3 知, 未开始消化实验时由于挤压后的马铃薯淀粉中存在着一部分未进行聚集交连的小分子单糖, 故螺杆挤压后马铃薯淀粉中的还原糖含量大于未经螺杆挤压淀粉中的还原糖含量。随着酶解实验的开始, 由于马铃薯原淀粉中 RDS含量多于经过螺杆挤压后马铃薯淀粉中 RDS的含量, 这些淀粉分子能够在酶溶液中迅速分解为单糖分子, 故在酶解时间 0~1.5 h 的时间内, 未经螺杆挤压的淀粉的还原糖含量增加的速度明显高于经螺杆挤压淀粉。当酶解时间从 1.5 h 增加到 6.5 h, 此时 RDS 消化完全, SDS 和 RS 先后开始与 α-猪胰淀粉酶作用降解为小分子的还原糖, 由于螺杆挤压后的马铃薯淀粉中 SDS 和 RS 的含量多于马铃薯的原淀粉中 SDS 和 RS 的含量, 故螺杆挤压后的马铃薯淀粉释放的还原糖含量大于马铃薯原淀粉释放的还原糖含量。由结果显示: 一方面在螺杆挤压的过程中马铃薯淀粉中的一些不消化的成分在高温高压高剪切的作用下, 变成可消化的小分子物质, 所以在整个消化的过程中所释放的还原糖的含量大于马铃薯原淀粉释放的还原糖的含量。另一方面, 螺杆挤压后的马铃薯淀粉进入机体后首先释放一部分还原糖为机体补充能量防止机体饥饿, 然后其中的 RS 和 SDS 发挥作用, 使其达到持续释放能量, 防止血糖上升过快的目的。
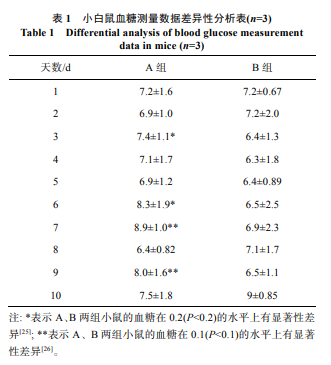
3.3 小鼠摄入马铃薯淀粉后血糖浓度变化分析
经 10 d 的针对性饲养后小鼠血糖浓度测定结果如表 1。显著性差异分析的过程中, 有不同的显著性水平包括 0.01、0.05、0.1、0.2 等, 根据实验性质的不同显著性水平也会各有不同。小鼠实验结果显示: 喂食 2 种不同的淀粉小鼠的平均血糖在 P<0.2 和 P<0.1 的水平上有差异性。因为螺杆挤压后的马铃薯淀粉中 RS 和 SDS 的占比马铃薯原淀粉高, 故在一定程度上可以减缓餐后血糖指数的升高。
4 结 论
螺杆挤压技术能规避化学方法的缺点, 通过高温、高压、高剪切力使马铃薯淀粉颗粒发生降解、聚集、交连等一系列变化。和其他传统的食品生产工艺相比, 有生产工艺简单、能耗低、三废排放少等优点, 还能够满足食品对于安全性的要求。体外模拟酶解实验证明螺杆挤压后马马铃薯淀粉中 RDS 含量少于马铃薯原淀粉中 RDS 的含量, SDS 和 RS 的含量高于马铃薯原淀粉。动物实验显示小鼠摄入经螺杆挤压的马铃薯淀粉后血糖浓度与摄入马铃薯原淀粉小鼠的血糖浓度的实验结果在 P<0.2 和 P<0.1 的水平上有差异性差异, 故螺杆挤压后的马铃薯淀粉对餐后血糖存在着一定的降低作用。这一实验说明螺杆挤压技术可以有效的改变马铃薯淀粉中各组分的占比, 提高 RS 和 SDS 的含量, 这一结果期望可以降低食用马铃薯淀粉后的升糖指数, 为马铃薯食品的深度开发提供一定的参考。——论文作者:樊佳玫, 俞东宁, 韩备竞, 寇梦璇, 牛付阁, 顾振宇, 潘伟春
参考文献
[1] 曾凡逵, 许丹, 刘刚. 马铃薯营养综述[J]. 中国马铃薯, 2015, 29(4): 233243. Zeng FK, Xu D, Liu G. Potato nutrition review [J]. Chin Potato J, 2015, 29(4): 233243.
[2] 聂涛. 马铃薯主粮化战略分析[J]. 现代农业科技, 2016, (6): 302303. Nie T. Strategic analysis of main grain for potato [J]. Mod Agric Sci Technol, 2016, (6): 302303.
[3] 卢肖平. 马铃薯主粮化战略的意义、瓶颈与政策建议[J]. 华中农业大学学报(社会科学版), 2015, (3): 17. Lu XP. Significance, bottlenecks and policy recommendations of staple food strategy in potato [J]. J Huazhong Agric Univ, 2015, (3): 17.
[4] Liljebergh, Björck I, Ostman E. Low glycaemic-index foods [J]. Br J Nutr, 2000, 83(S1): 149155.
[5] 马海, 马宝成. 农村糖尿病患者的饮食和用药指导[J]. 内蒙古中医药, 2013, 32(24): 129. Ma H, Ma BC. Diet and medication guidance for patients with diabetes in rural areas [J]. Nei Mongol J Tradit Chin Med, 2013, 32(24): 129.
[6] Lea B, Eric BR, Walter CW, et al. Potato intake and incidence of hypertension: results from three prospective US cohort studies [J]. British Med J, 2016, 353: i2351.
[7] 李周勇, 韩育梅, 夏德冬. 马铃薯抗性淀粉的微波预处理条件及性质研究 [J], 食品研究与开发, 2014, 35(2): 16. Li ZY, Han YM, Xia DD. Study on microwave pretreatment conditions and properties of potato resistant starch [J]. Food Res Dev, 2014, 35(2): 16.
[8] 聂凌鸿. 马铃薯抗性淀粉压热制备条件的研究[J]. 安徽农业科学, 2008, 36(1): 314315. Nie LH. Study on the preparation conditions of potato resistant starch [J]. Anhui Agric Sci, 2008, 36(1): 314315.
[9] 孟天真. 中式烹饪对马铃薯抗性淀粉的影响研究[D]. 杭州: 浙江大学, 2012. Meng TZ. Effect of Chinese cooking on potato resistant starch [D]. Hangzhou: Zhejiang University, 2012.
[10] Mccleary BV, Mcnally M, Rossiter P. Measurement of resistant starch by enzymatic digestion in starch and selected plant materials: collaborative study [J]. J Aoac Int, 2002, 85(5): 11031111.
[11] Van de Voort FR. Drying technology [J]. Food Extrus Sci Technol, 1993, 11(2): 417418.
[12] 任海斌, 肖志刚, 赵妍, 等. 挤压一酶解联用抗性淀粉制备工艺的优化研究[J]. 中国粮油学报, 2017, 32(2): 3036. Ren HB, Xiao ZG, Zhao Y, et al. Optimization of preparation technology of resistant starch by extrusion and enzymatic hydrolysis [J]. J Cere Oils Ass, 2017, 32(2): 3036.
[13] 李俊伟, 唐书泽, 张志森, 等. 挤压法制备大米抗性淀粉中系统参数控制与目标参数的关系[J]. 食品科学, 2008, 29(12): 381384. Li JW, Tang SZ, Zhang ZS, et al. Relationship between system parameter control and target parameters in rice resistant starch prepared by extrusion method [J]. Food Sci, 2008, 29(12): 381384.
澹版槑:鈶犳枃鐚潵鑷煡缃戙€佺淮鏅€佷竾鏂圭瓑妫€绱㈡暟鎹簱锛岃鏄庢湰鏂囩尞宸茬粡鍙戣〃瑙佸垔锛屾伃鍠滀綔鑰�.鈶″鏋滄偍鏄綔鑰呬笖涓嶆兂鏈钩鍙板睍绀烘枃鐚俊鎭�,鍙仈绯�瀛︽湳椤鹃棶浜堜互鍒犻櫎.

SCISSCIAHCI