0
留言稍后联系!

发布时间:2019-09-30所属分类:医学职称论文浏览:1502次
摘 要: 摘要:唾液酸是一类携带负电荷的九碳单糖,在体内广泛分布。唾液酸具有多种多样的生物学功能,而肿瘤细胞表面唾液酸异常高表达能够保护肿瘤细胞免受免疫系统的识别和攻击。其作用机理主要是通过干扰机体免疫系统中的免疫细胞与免疫分子,抑制一系列抗肿瘤免

摘要:唾液酸是一类携带负电荷的九碳单糖,在体内广泛分布。唾液酸具有多种多样的生物学功能,而肿瘤细胞表面唾液酸异常高表达能够保护肿瘤细胞免受免疫系统的识别和攻击。其作用机理主要是通过干扰机体免疫系统中的免疫细胞与免疫分子,抑制一系列抗肿瘤免疫应答的发生,如抑制补体系统的活化,阻碍抗原提呈细胞的激活,削弱免疫效应细胞的杀伤作用和促进免疫抑制性细胞因子的分泌等,进而介导肿瘤免疫逃逸。本综述主要阐述的是唾液酸的结构和生物学功能以及其在肿瘤免疫逃逸中的作用及机制。
关键词:唾液酸;免疫逃逸;免疫细胞;免疫分子;免疫治疗
近年来,对肿瘤的发生、发展以及肿瘤免疫逃逸机制的研究不断深入,其中免疫逃逸对于肿瘤细胞的存活至关重要。唾液酸是一类携带负电荷的九碳单糖,具有强大的免疫调节能力。研究肿瘤细胞表面唾液酸的高表达会削弱免疫系统的监视和攻击能力,进而介导肿瘤免疫逃逸。本文将重点阐述唾液酸的结构和生物学功能及其在肿瘤免疫逃逸中的作用,以期为肿瘤的防治提供更多理论依据。
1 唾液酸的概述
1.1 唾液酸的结构与分类
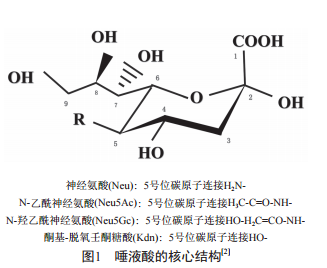
唾液酸是一类携带负电荷的九碳单糖,以糖甙的形式存在于糖蛋白和糖脂的糖链末端[1]。它的核心结构有四种(如图1[2]):神经氨酸(Neu)、N-乙酰神经氨酸(Neu5Ac)、N-羟乙酰神经氨酸(Neu- 5Gc)和酮基-脱氧壬酮糖酸(Kdn),其中,Neu5Ac 是哺乳动物中最常见的唾液酸衍生物[3]。唾液酸修饰是指唾液酸在唾液酰基转移酶的作用下将唾液酸供体CMP-Neu5Ac的唾液酸基连接于糖蛋白、糖脂的末端,是糖基化修饰的主要形式之一[4]。研究表明,唾液酸转移酶的表达程度与肿瘤发生发展有着紧密的联系,它可以通过影响细胞膜表面糖复合物的唾液酸化数量或结构而发挥作用,唾液酰基转移酶(sialyltransferase, ST)ST3Gal-I、ST- 3Gal-III、ST6Gal-I等多种唾液酰基转移酶的过表达已被证实与肿瘤的侵袭和预后相关[5-7]。
1.2 唾液酸的生物学活性
唾液酸具有多种多样的生物学功能,如细胞表面糖复合物末端的唾液酸能够介导细胞之间信息的传递,还可以作为被识别的受体与许多配体 (如选凝素、凝集素、细胞黏附蛋白分子等)结合,主要参与细胞间的黏附过程。此外,糖复合物末端唾液酸能够屏蔽糖蛋白和糖脂的结构,抑制细胞或分子与其特异性识别位点的结合,进而躲避免疫系统的监视,促进免疫逃逸的发生[8-10]。已有研究表明,肿瘤细胞恶性程度与其表面唾液酸含量密切相关:肿瘤细胞表面的唾液酸含量越高,肿瘤细胞的转移性越强。据相关文献报道,血清中的唾液酸已经可以作为一种广泛有效的肿瘤标志物[11]。
2 肿瘤免疫逃逸的主要机制
2.1 肿瘤细胞与肿瘤免疫逃逸
肿瘤细胞和免疫系统之间的相互作用能够影响肿瘤的发生与发展。肿瘤细胞可通过异常表达肿瘤细胞表面抗原,改变肿瘤细胞表面的分子结构和分泌免疫抑制因子等一系列措施抑制机体免疫系统对肿瘤细胞的识别和攻击,从而促进肿瘤免疫逃逸的发生。据文献报道,肿瘤细胞表面唾液酸异常高表达会抑制免疫系统对肿瘤细胞的监视和攻击进而介导免疫逃逸的发生[12]。
2.2 机体免疫系统与肿瘤免疫逃逸
免疫系统是机体非常重要的防御系统,肿瘤的发生与否与机体免疫系统的功能密不可分,肿瘤发生的可能性会由于免疫系统功能低下或受抑制而提高。肿瘤微环境是指肿瘤细胞生活及其与机体免疫系统相互作用的场所,其中包括髓源抑制性细胞和肿瘤相关巨噬细胞等免疫抑制性细胞,T细胞、自然杀伤细胞(natural killer cell, NK 细胞)及树突状细胞等功能缺陷的免疫细胞,以及一系列免疫抑制因子[13]。免疫抑制的肿瘤微环境在一定程度上可增强肿瘤的侵袭力,进而提高肿瘤免疫逃逸发生的可能性[14]。研究表明,肿瘤细胞表面唾液酸的异常高表达会抑制相关免疫细胞和免疫分子的功能从而介导肿瘤免疫逃逸,接下来,本文将对这两方面进行重点阐述。
3 唾液酸与肿瘤免疫逃逸
3.1 免疫细胞与唾液酸
3.1.1 树突状细胞
树突状细胞(dendritic cell, DC)是一种活跃的专职抗原提呈细胞。成熟DC诱导外源性抗原的免疫应答,可以通过提呈肿瘤抗原,高表达共刺激分子以及黏附分子从而促进T细胞介导的免疫应答,未成熟DC则诱导自身免疫耐受。因此,DC的成熟与否可以决定免疫应答的结局。据报道,肿瘤细胞表面唾液酸化结构,如黏蛋白、神经节苷脂[15],可以抑制DC的活化与成熟,进而阻碍T细胞抗肿瘤免疫应答的发生。
黏蛋白是一类高相对分子质量糖蛋白。研究发现,高度唾液酸化的黏蛋白能够与DC上的唾液酸结合性免疫球蛋白样凝集素(Siglecs)结合并抑制其激活。黏蛋白1可以使未成熟DC聚集并诱导其成熟。但是,这类DC功能不全,既不能产生白细胞介素-12(interleukin-12, IL-12),也不能激活T细胞的免疫应答。黏蛋白2与唾液酸在唾液酰基转移酶的作用下以α-2,6糖苷键连接以后,可以与单核细胞源性的DC表面sigelec-3结合并诱导其凋亡;当与siglec-9结合后,会减弱IL-12的生成[16-17]。神经节苷脂是一类含有唾液酸的糖鞘脂。人脑中有9 种主要的神经节苷脂,分别为GM1a、GM2、 GM3、GM4、GD1a、GD1b、GT1a、GT1b和 GD3。在神经母细胞瘤中,肿瘤细胞表面的GD2 会抑制DC的活化,IL-12的产生以及效应T细胞的激活[18]。在黑色素瘤中,肿瘤细胞表面的GM3和 GD3也会抑制DC的活化并诱导其凋亡[19-20]。GalNAc-GD1a最初是作为脑神经节苷脂而发现的,但随后发现抗GalNAc-GD1a的自身抗体与吉兰-巴雷综合征(Guillain-Barre syndrome, GBS)的发生密切相关。吉兰-巴雷综合征是一类自身免疫性、周围神经炎性疾病,以对称性、弛缓性肢体瘫痪为主要临床特点。研究表明,吉兰-巴雷综合征患者的血清与天然和合成的GalNAc-GD1a均有反应[21]。
综上,我们可以发现,肿瘤细胞表面的唾液酸聚糖可通过抑制DC的活化、诱导DC的凋亡、阻碍抗肿瘤免疫应答的发生,进而促进肿瘤免疫逃逸。
3.1.2 NK细胞
自然杀伤细胞(natural killer cell, NK细胞)是固有免疫系统的重要组成成分之一,它不需特异性抗原刺激便可直接发挥杀伤效应。肿瘤细胞可以通过表达与NK细胞抑制性受体相结合的配体,或者下调与活化性受体相结合的配体的表达来抑制 NK细胞介导的肿瘤杀伤作用[22]。有关研究表明, NK细胞杀伤活性与肿瘤细胞表面唾液酸化相关。肿瘤细胞的唾液酸化不仅可以阻碍肿瘤细胞与NK 细胞之间的物理作用,而且可以遮蔽肿瘤细胞表面能够与之结合的活化性配体。此外,肿瘤细胞表面的唾液酸化会导致肿瘤细胞和NK细胞之间的免疫突触形成受阻,从而削弱NK细胞对肿瘤的杀伤毒性。这可能与NK细胞表面活化性受体NKG2D 不能识别肿瘤细胞表面经唾液酸修饰的活化性配体有关,亦或与细胞膜表面的唾液酸携带大量的负电荷相关。已有研究发现,从患有纤维肉瘤的小鼠中提取肿瘤细胞,免疫功能受损的小鼠的肿瘤细胞表面唾液酸的表达水平要低于免疫功能正常的鼠;将这些低唾液酸化的肿瘤细胞接种至免疫功能正常的鼠中会出现明显的生长抑制。以上结果表明,唾液酸的高表达有利于肿瘤的免疫逃逸[23]。
此外,研究发现,肿瘤细胞表面的唾液酸化还可以通过触发由Siglecs介导的免疫抑制信号来抑制NK细胞的杀伤活性。Siglec-7表达于大部分的 NK细胞表面,而肿瘤细胞表面以α-2,8糖苷键连接的唾液酸与NK细胞表面的Siglec-7结合后,会抑制 NK细胞的活化,从而使肿瘤细胞逃逸NK细胞介导的杀伤功能[24-25]。
3.1.3 细胞毒T淋巴细胞
细胞毒T淋巴细胞(cytotoxic T lymphocytes, CTL)是一类适应性免疫细胞。该细胞主要通过释放穿孔素,颗粒酶以及Fas/FasL介导的靶细胞凋亡两大机制介导靶细胞死亡。肿瘤细胞表面唾液酸聚糖的异常高表达可以通过干扰CTL活化和杀伤机制来促进免疫逃逸的发生。有相关研究证实,肿瘤细胞表面的神经节糖苷(如GD1a)会抑制CTL 中胞浆颗粒的运输和胞吐,从而抑制胞浆颗粒中的穿孔素、颗粒酶等内容物作用于靶细胞并介导靶细胞死亡[26]。此外,肿瘤细胞表面Fas的高度唾液酸化可抑制由Fas和FasL介导的肿瘤细胞凋亡的发生[27]。综上,肿瘤细胞主要是通过其表面唾液酸聚糖的异常高表达抑制CTL的两条杀伤途径,进而促进肿瘤免疫逃逸的发生。
3.1.4 巨噬细胞
巨噬细胞(macrophages)是具有异质性的一群免疫细胞,对机体的免疫防御功能及对组织稳态的维护发挥着至关重要的作用。肿瘤细胞表面的唾液酸聚糖一方面会促进巨噬细胞的识别和吞噬功能,而另一方面还可诱导巨噬细胞释放促进肿瘤细胞生长、侵袭的细胞因子,从而介导肿瘤免疫逃逸。巨噬细胞表面通常会表达SigIec-1,其结构高度保守,主要介导细胞间的黏附。Siglec-1阳性的巨噬细胞可以结合和清除含唾液酸结构的病原体[28]。此外,相关研究表明,Siglec-1阳性巨噬细胞还可以吞噬死亡的肿瘤细胞并将其抗原递呈给CTL,从而介导抗肿瘤免疫应答的发生;而Siglec-1被阻断,则会抑制CTL的活化和一系列的抗肿瘤免疫应答[29]。研究发现,Siglec-1阳性巨噬细胞在自身免疫性炎症的发生中也发挥着重要的作用,如肾小球肾炎,Siglec-1阳性的巨噬细胞积聚可引起肾小球的损伤,进而出现水肿、蛋白尿、血尿、高血压、少尿或无尿等临床表现,糖皮质激素治疗后其表达可下降。此外,关节炎、葡萄膜视网膜炎的发生也与其表达密切相关[30]。已有文献证实,肺癌细胞表面以α-2,6糖苷键连接的唾液酸会促进Siglec-15阳性的单核巨噬细胞分泌免疫抑制性细胞因子TGF-β(transforming growth factor- β)。肿瘤细胞表面的唾液酸聚糖还会抑制Siglec-9 阳性的巨噬细胞TNF-α的分泌,但促进IL-10的分泌。由此可见,肿瘤细胞表面唾液酸的表达与巨噬细胞表面Siglec的表达共同决定了细胞因子的类型,进而影响肿瘤的免疫逃逸的发生发展。
3.2 免疫分子与唾液酸
作为免疫系统的重要组成部分,免疫分子在维系免疫系统的稳定中发挥重要的功能。其中,补体系统是先天免疫的重要组成成分之一,在各种激活物的作用下补体固有成分按照一定顺序被活化,进而发挥其重要的生理作用[31]。H因子是补体系统中重要的调节蛋白。在脊椎动物中,宿主细胞表面的唾液酸或某些硫酸黏多糖及其他负性分子能够被H因子上的阴离子黏附域特异性的识别。当H因子与宿主细胞表面的唾液酸结合时,机体的补体旁路激活途径被阻滞,从而逃避补体系统激活而造成的损伤[32]。肿瘤细胞通过细胞膜表面糖复合物的唾液酸化来逃避补体系统介导的对肿瘤细胞的杀伤作用,此外,某些肿瘤细胞还能通过自身生成H因子介导补体系统的杀伤作用[33]。据报道,应用唾液酸酶去除某些肿瘤细胞表面的唾液酸能够促进补体系统介导的细胞溶解或调理吞噬作用[34]。H因子作为一种补体调节蛋白,在补体C3b存在的条件下,能够识别宿主细胞表面的唾液酸并加速C3b的衰变。当H因子中参与唾液酸识别的C末端结构域发生基因突变,或者在自身抗体的作用下,其可通过促进补体的过度活化进而导致非典型溶血性尿毒综合征和年龄相关性黄斑变性等免疫相关疾病的发生[35]。
4 唾液酸与肿瘤免疫治疗
肿瘤免疫治疗是一种新型的治疗方式,随着对肿瘤免疫逃逸机制及免疫治疗新靶点的逐步了解,肿瘤免疫治疗已逐步成为肿瘤治疗的重要措施。唾液酸拥有强大的免疫调节能力,肿瘤细胞表面唾液酸的高表达会削弱免疫系统的监视和攻击能力,因此,很多研究者认为唾液酸可以作为肿瘤免疫治疗的新靶点[36]。Neu5Gc发现于众多哺乳动物中,人体内由于缺乏相应的酶而无法合成,但是可通过食物摄取进入到人体内。这种通过外源性摄入的Neu5Gc与某些肿瘤的发生相关,随着肿瘤组织中Neu5Gc的增多,抗原表位也随之增多。这种抗原表位具有肿瘤特异性,因此,可以作为肿瘤免疫治疗的靶点。但是,还需对其安全性及有效性做进一步的研究[37-39]。随着动物肿瘤模型和临床试验方面的不断进展,抗癌疫苗以及抗体疗法将会得到更深层次的探索[40-43]。
推荐阅读:抗肿瘤的论文可以投哪些杂志
5 结语
综上所述,肿瘤细胞表面唾液酸的表达情况与肿瘤的发生发展联系密切。唾液酸可以通过削弱免疫细胞功能、干扰补体系统的活化、促进免疫抑制性细胞因子的分泌等一系列措施介导肿瘤免疫逃逸的发生(图2)。随着糖生物学和糖化学的迅速发展,以及对肿瘤免疫逃逸机制的深入了解,肿瘤免疫疗法已受到肿瘤治疗领域越来越多的重视,以唾液酸为靶点开发的靶向治疗药物也有望应用于肿瘤的治疗。在以后的研究过程中,值得思考的是如何能够真正有效地抑制肿瘤细胞表面的异常唾液酸化,或者去除肿瘤细胞异常高表达的唾液酸,甚至通过激活机体免疫系统抵抗肿瘤细胞表面异常的唾液酸化。但是,由于免疫逃逸机制综合作用的复杂性以及肿瘤的高度异质性,仍有很多困难需要解决,有待科研工作者进行更加深入的研究。
声明:①文献来自知网、维普、万方等检索数据库,说明本文献已经发表见刊,恭喜作者.②如果您是作者且不想本平台展示文献信息,可联系学术顾问予以删除.

SCISSCIAHCI